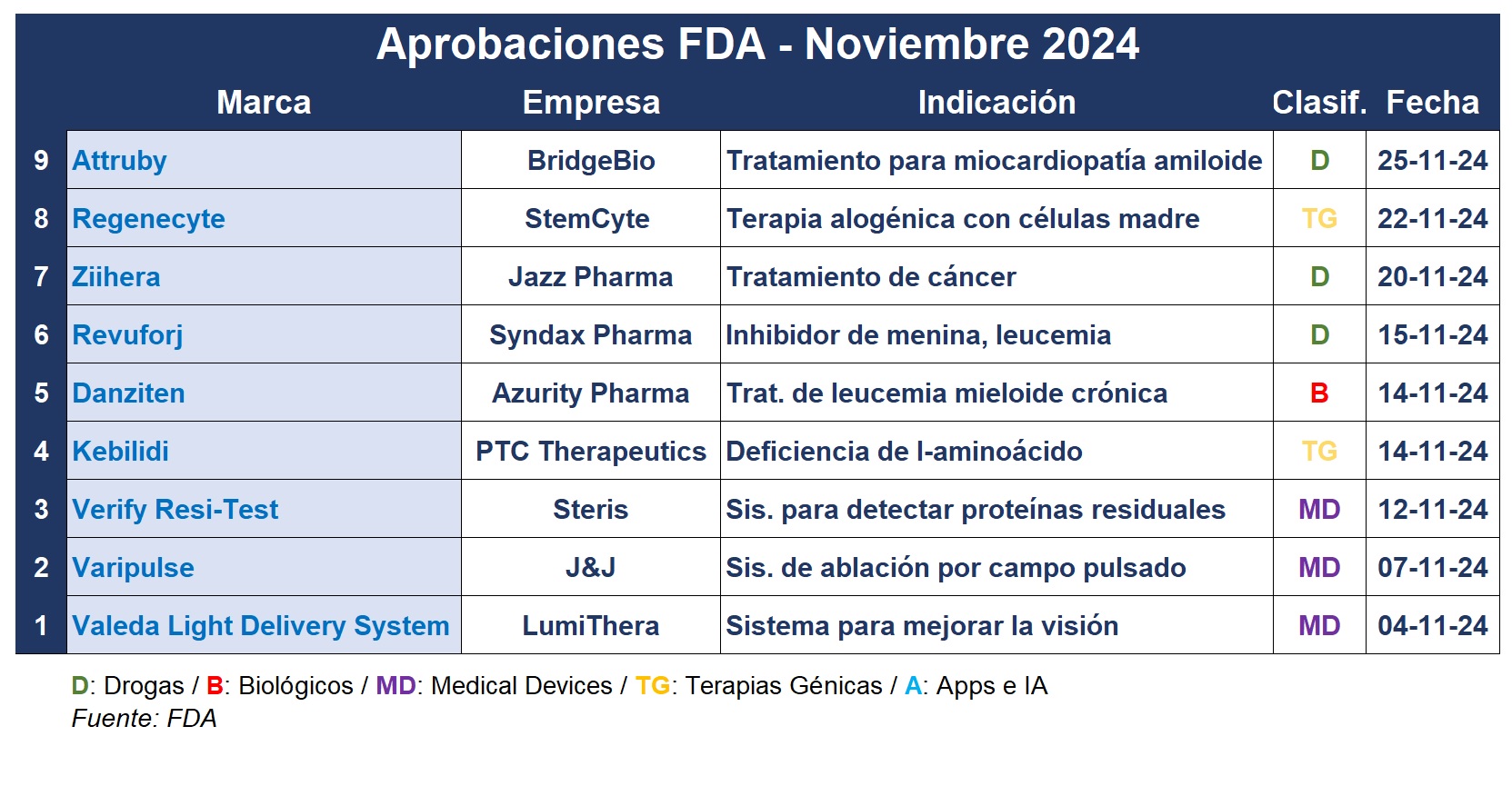
Noviembre llegó a su fin, registrando una nueva lista de aprobaciones por parte de la FDA. El anteúltimo mes del año incluyó desarrollos tales como una terapia génica que se administra directo al cerebro, dos tratamientos para la leucemia, y tres nuevos dispositivos médicos.
Las aprobaciones no perdieron ritmo durante el anteúltimo mes del 2024. Por caso, PTC Therapeutics, de New Jersey, anunció que recibió el primer aval de la FDA para una terapia génica que se administra directamente al cerebro. Se trata de Kebilidi, indicada para la deficiencia de l-aminoácido aromático descarboxilasa, una enfermedad ultra rara que afecta a menos de 1.000 personas en EEUU. Ver FDA aprobó Kebilidi
Además, la FDA aprobó la solicitud de licencia para Regenecyte, una terapia génica elaborada con sangre del cordón umbilical a partir de células progenitoras hematopoyéticas. La aprobación convierte a la estadounidense StemCyte en la primera biotech comercial en recibir una licencia para este tipo de terapia celular. Ver FDA avala el biológico Regenecyte
El organismo regulatorio también aprobó Varipulse, un dispositivo de la estadounidense Johnson & Johnson. Se trata de un sistema de ablación por campo pulsado para tratar la fibrilación auricular, una enfermedad que se caracteriza por un ritmo cardíaco irregular. Ver FDA: OK para Varipulse de J&J
Y en paralelo en este noviembre, la FDA avaló el uso de Revuforj de la norteamericana Syndax Pharmaceuticals como el primer inhibidor de la menina para tratar un tipo genético de leucemia llamada lisina metiltransferasa 2A (KMT2A). La autorización se aplica a pacientes de un año o más con leucemias recidivantes o refractarias que presentan reordenamientos del gen KMT2A. Es el segundo nuevo medicamento de Syndax aprobado en los últimos tres meses. Niktimvo, que comercializa con Incyte, recibió el OK de la FDA en agosto. Ver Press Release
En noviembre a su vez, la FDA dio su aval al Valeda Light Delivery System de la norteamericana LumiThera. El sistema utiliza tres diodos emisores que generan luz en diferentes longitudes de onda para ayudar a mejorar la visión en ciertos pacientes con degeneración macular seca relacionada con la edad. Ver Press Release
También en noviembre, le llegó la autorización de comercialización a Steris VERIFY RESI-TEST SLIDE-THRU Cleaning Process Protein Indicator. Este sistema se utiliza para detectar proteínas residuales en el suelo extraídas de un cepillo utilizado en las luces de los dispositivos médicos después de la limpieza y antes de la desinfección o esterilización de alto nivel. La presencia de proteínas residuales se evalúa mediante el cambio de color de la solución. Ver Press Release
Por otro lado, la estadounidense Azurity Pharmaceuticals obtuvo el visto buen para Danziten a base de nilotinib. El producto es una nueva formulación de Tasigna, el blockbuster de Novartis para tratar la leucemia mieloide crónica (LMC), que no requiere tomar los medicamentos con el estómago vacío. El visto bueno es para pacientes con LMC con cromosoma Filadelfia positivo recién diagnosticada en fase crónica y adultos con LMC Ph+ en fase crónica o aguda que son intolerantes a una terapia previa que incluía la quimioterapia Gleevec. Ver Press Release
La FDA también concedió una autorización acelerada a Ziihera, de la irlandesa Jazz Pharmaceuticals. Administrado de manera intravenosa y a base de zanidatamab-hrii, el producto está indicado para tratar el cáncer de las vías biliares metastásico HER2-positivo. Ziihera está aprobado para su uso en adultos que hayan recibido tratamiento previo, y se desarrolló junto con Beigene después de que Jazz adquiriera los derechos exclusivos de Zymeworks. Ver Press Release
Otra aprobación de noviembre es Attruby, de la norteamericana BridgeBio. El mismo es un tratamiento para la miocardiopatía amiloide por transtiretina, una enfermedad cardíaca rara y mortal. El producto oral, a base de acoramidis, está indicado para uso en adultos y entrará en un mercado dominado por el blockbuster Vyndaqel de Pfizer. Ver FDA: OK para Attruby de BridgeBio
Asimismo, la austríaca AOP Orphan Pharmaceuticals recibió el aval de la FDA para Rapiblyk, un antagonista del receptor adrenérgico de acción ultracorta indicadao para uso en cuidados críticos hospitalarios para el tratamiento de la taquicardia supraventricular grave, una severa afección cardíaca. A base de landiolol, el producto ofrece una nueva opción de tratamiento y se convierte en el primer producto de AOP aprobado en Estados Unidos. Ver Press Release