La FDA cerró el tercer mes del año con aprobaciones para productos novedosos, así como renovadas indicaciones para productos ya conocidos. La lista incluye un tratamiento para el ACV que actúa en segundos, una terapia génica que se administra a través del ojo, y un nuevo desarrollo veterinario, entre otras.
Los cambios administrativos en la presidencia de los EE.UU supusieron nuevos desafíos para la agencia regulatoria en estos primeros meses del año. Tal fue el caso de la vuelta a la presencialidad, así como el nombramiento del nuevo jefe del organismo. Ver FDA: caótico regreso a la oficina // Ver Confirman a Makary como jefe de la FDA
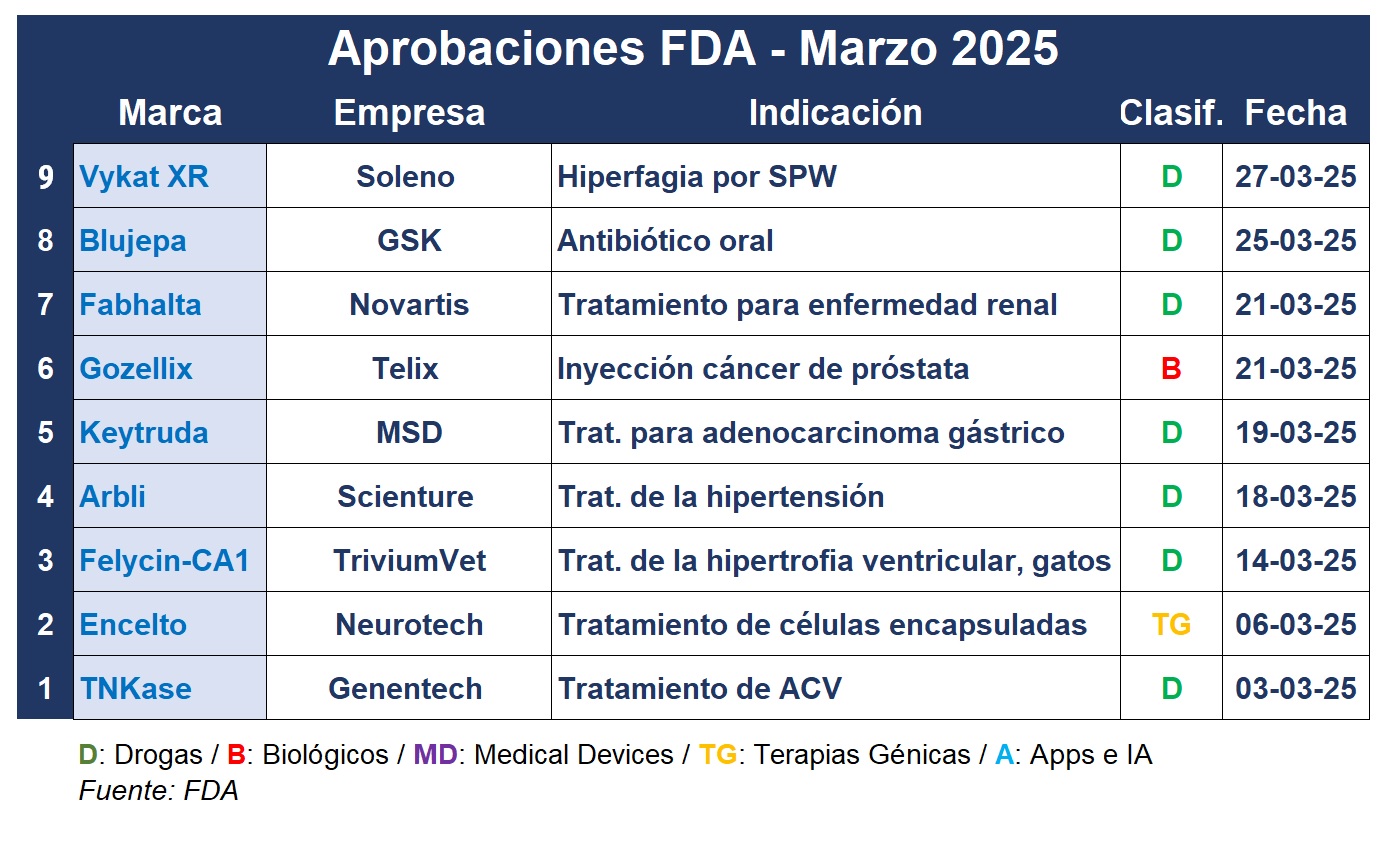
Y en ese contexto, fueron varias la aprobaciones registradas. Resaltó por caso Encelto, de la norteamericana Neurotech Pharmaceuticals, el primer producto avalado por la FDA para el tratamiento de pacientes con telangiectasia macular idiopática tipo 2 (MacTel). Es una terapia celular encapsulada que se aplica directamente en la retina y se implanta quirúrgicamente. Ver FDA: luz verde para Encelto
En tanto, Genentech consiguió una segunda aprobación para TNKase. La inyección intravenosa fue aprobada en el año 2000 para reducir el riesgo de muerte por infarto agudo de miocardio (IAM) con elevación ST. En marzo, sumó una indicación para tratar el ACV, desplazando a Activase, el standard de tratamiento anterior y también desarrollado por la subsidiaria de la suiza Roche. Ver FDA: expande aval
Además, la suiza Novartis anunció que la FDA autorizó su inhibidor del factor B del complemento Fabhalta para el tratamiento de adultos con glomerulopatía C3 (G3C). El producto se convierte en la primera terapia aprobada para esta enfermedad renal rara y potencialmente mortal. De esta manera Fabhalta ya tiene el OK para tres indicaciones diferentes, agregándose a este la hemoglobinuria paroxística nocturna y la nefropatía primaria por inmunoglobulina A. Ver FDA: nuevo OK para Fabhalta
Y el laboratorio británico GSK logró lo que definió como la segunda de las cinco aprobaciones claves que quiere de la FDA este año. Se trata de Blujepa, el primer nuevo tipo de antibiótico oral para las infecciones del tracto urinario (ITU) en casi 30 años. A base de gepotidacina, actúa sobre una parte diferente de la bacteria en comparación con la mayoría de los demás antibióticos, lo que lo hace eficaz contra organismos resistentes a los tratamientos actuales. Está aprobado para su uso en mujeres de 12 años en adelante. Ver FDA: luz verde para Blujepa
La australiana Telix Pharmaceuticals obtuvo el OK para Gozellix, un kit para la preparación de la inyección de galio-68, un agente de imagen PET-PSMA de nueva generación para el cáncer de próstata. El producto está indicado para la exploración PET de lesiones positivas para PSMA en hombres con sospecha de metástasis y candidatos a terapia definitiva inicial o con sospecha de recurrencia basada en niveles elevados de antígeno prostático específico sérico. Tiene una vida útil más larga y un radio de distribución más amplio respecto a los productos existentes y a base de galio. Ver Press Release
La lista de marzo incluye también a la norteamericana Soleno Therapeutics, que recibió el aval de la agencia regulatoria para Vykat XR. El mismo se constituye en el primer tratamiento disponible para pacientes que experimentan una sensación de hambre intensa y persistente por causa del síndrome de Prader-Willi (SPW). A base de diazoxide choline, el producto oral trata la hiperfagia, el síntoma distintivo de esta enfermedad genética rara. Ver FDA: OK para Vykat XR
En cuanto a nuevas formulaciones, Scienture recibió el OK para Arbli, una formulación líquida oral de losartán indicada para el tratamiento de la hipertensión en pacientes mayores de 6 años, para reducir el riesgo de accidente cerebrovascular en pacientes con hipertensión e hipertrofia ventricular izquierda y para el tratamiento de la nefropatía diabética en ciertos pacientes con diabetes tipo 2. Arbli es el primer losartán líquido oral aprobado por la FDA. Ver Press Release
Por otro lado, Keytruda, el blockbuster de la estadounidense MSD, sigue sumando aprobaciones. El producto ahora cuenta con la aprobación tradicional de la FDA para su uso con trastuzumab, fluoropirimidina y quimioterapia con platino para el tratamiento en primera línea de adultos con adenocarcinoma gástrico o de la unión gastroesofágica HER2 positivo, localmente avanzado, irresecable o metastásico, cuyos tumores expresan PD-L1. El producto ya recibió la aprobación acelerada para esta indicación en el 2021. Ver Press Release
Asimismo, el último viernes del mes se concretaron dos aprobaciones. Por un lado, la FDA le dio el visto bueno a Qfitlia de la francesa Sanofi. La terapia subcutánea para la hemofilia ayuda a prevenir el sangrado y reduce la antitrombina, una proteína que retrasa la coagulación sanguínea. Está indicada para mayores de 12 años. Ver aprobación Qfitlia
En paralelo, la agencia autorizó la comercialización de la primera prueba que se puede realizar completamente en el hogar en pos de detectar tres infecciones de transmisión sexual (ITS). La Visby Medical Women’s Sexual Health Test no requiere el envío de muestras a un laboratorio como otras pruebas existentes para clamidia, gonorrea y tricomoniasis. Ver aprobación test ITS
En cuanto a los productos veterinarios, la FDA anunció la aprobación condicional de Felycin-CA1, tabletas de sirolimus de liberación retardada de la irlandesa TriviumVet. Es el primer medicamento indicado para el tratamiento de la hipertrofia ventricular en gatos con miocardiopatía hipertrófica subclínica. Es la cardiopatía felina más común y una de las causas más comunes de muerte. Ver Press Release