La EMA publicó su clásico “Human medicines: highlights of 2021”, el reporte en el que muestra de un vistazo las recomendaciones de autorización que otorgó en el año. Es en función de que el organismo no da el OK final, sino que sugiere a los Estados miembros de la UE qué medicamentos aprobar. En el año que cerró fueron 92 terapias, de las cuales 53 implican nuevas drogas. Este número está en consonancia con la FDA, que le dio luz verde a 50 nuevas moléculas.
La agencia europea dio a conocer las recomendaciones de autorización para nuevos medicamentos que otorgó en el 2021. En el documento resume los principales highlights regulatorios en referencia al segmento de “Human Medicines” durante el año que cerró. Ver Press Release.
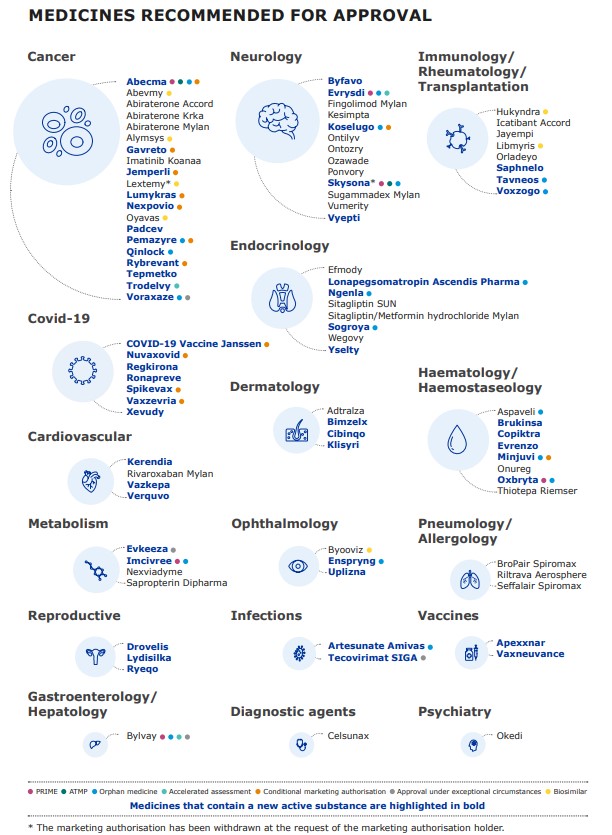
Allí la EMA comunicó que recomendó 92 medicamentos para que obtengan una autorización de comercialización, de los cuales 53 tenían un nuevo ingrediente activo que hasta el momento nunca había sido aprobado en la Unión Europea. El organismo detalló que esta última cifra significó un incremento del 35% en comparación con el año anterior. Ver Documento.
El COVID-19 fue una prioridad para la agencia. En total recomendó cuatro vacunas y cinco tratamientos para hacerle frente a la pandemia. Además, la EMA resaltó que a lo largo del año, le levantó el pulgar a 33 nuevos sites de manufactura de vacunas contra el coronavirus, lo que generó un aumento sustancial en la capacidad de elaboración y suministro.
El segmento de Onco quedó, una vez más, a la cabeza. Fueron 20 las terapias para el tratamiento del cáncer que obtuvieron luz verde, de las cuales 12 implican una novedad por su sustancia activa. Además, de dicha cifra cuatro son biosimilares y otros cuatro fueron designados como drogas huérfanas.
Por otro lado, la agencia dio el OK para 13 medicamentos pertenecientes al mercado de Neurología y cinco de ellos implicaron nuevas moléculas. En paralelo, recomendó ocho terapias enroladas en Hematología/Hemostaseología, de las que cinco contienen nuevos APIs; y otras ocho para Imuno, Reumato y Transplantes, de las cuales tres son nuevas drogas. Respecto de los biosimilares, fueron en total siete los recomendados por la agencia europea para que sean aprobados.
En su informe la EMA resaltó varios medicamentos que representaron un significativo progreso en sus áreas terapéuticas. Por caso se destacaron la terapia génica Abecma, de la norteamericana BMS, y Trodelvy, de la biotecnológica Gilead, ambos enrolados como oncológicos; así como los inmunológicos Tavneos, de la estadounidense Chemocentryx, y Voxzogo, de su connacional Biomarin; y el neurológico Evrysdi, de la suiza Roche.
Además sobresalió el aporte de Bylvay, de la norteamericana Albireo, en Gastroenterología y Hepatología; el de Imcivree, de Rhythm Pharmaceuticals, englobado en la categoría de Metabolismo; y el de Enspryng, de Roche, en Oftalmología.
Durante 2020, la agencia le levantó el pulgar a 97 tratamientos a fin de que sean autorizados para su comercialización. De dicha cifra, 39 se constituyeron como una novedad por tener una droga que nunca antes había recibido luz verde en la Unión Europea. Ver «EMA: los highlights del 2020».