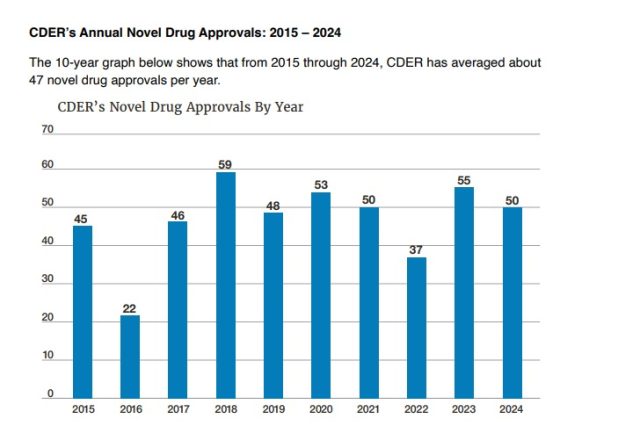
La FDA hizo público hoy su tradicional informe en el que repasa las aprobaciones del 2024. Allí se compilan las 50 nuevas moléculas que el organismo avaló durante el año pasado. En el 2023, en tanto, las aprobaciones habían sido 55.
Las aprobaciones de la FDA siempre se constituyeron como un faro para el resto de sus organismos pares, los que toman como referencia muchas de sus decisiones respecto de la aprobación de nuevos productos. En ese contexto, resulta relevante pasar revista a cada una de las aprobaciones del organismo durante el 2024, las que fueron compiladas hoy en un informe especial. Ver Documento
De acuerdo con el documento la agencia le dio el visto bueno a 50 moléculas nóveles durante el año pasado. Así generó menos avales respecto del 2023, cuando surgieron 55 productos aprobados. A su vez, en el 2024, se empató con la cantidad de aprobaciones que se habían registrado en el año 2021. Ver Informe FDA del 2023
A su vez se informó que 24 de las 50 nóveles drogas aprobadas, es decir, el 48% fueron rotuladas como primeras en su clase. Las mismas fueron Anktiva, de ImmunityBio; Aqneursa de IntraBio; Bizengri de Merus; Cobenfy de BMS; Crenessity de Neurocrine Biosciences; Duvyzat de Italfarmaco; Hympavzi, de Pfizer; Imdelltra, de Amgen; Iqirvo, de Ipsen y Genfit; y Lumisight, de Lumicell.
También Miplyffa, de Zevra; Nemluvio, de Galderma; Niktimvo, de Incyte; Revuforj, de Syndax Pharmaceuticals; Rezdiffra, de Madrigal; Rytelo, de Geron; Tryngolza, de Ionis Pharmaceuticals; Tryvio, de Idorsia; Voydeya, de AZ; Vyloy, de Astellas; Winrevair, de MSD; Xolremdi, de X4; Zelsuvmi, de Ligand; y Ziihera, de Jazz Pharmaceuticals. A su vez, el otro gran dato es que de las dueñas de estas 24 moléculas, solo seis empresas operan de forma directa en la Argentina.
Asimismo, durante el 2024, fueron 26 de las 50 nuevas moléculas aprobadas, es decir el 52%, las que están orientadas a enfermedades raras o huérfanas.