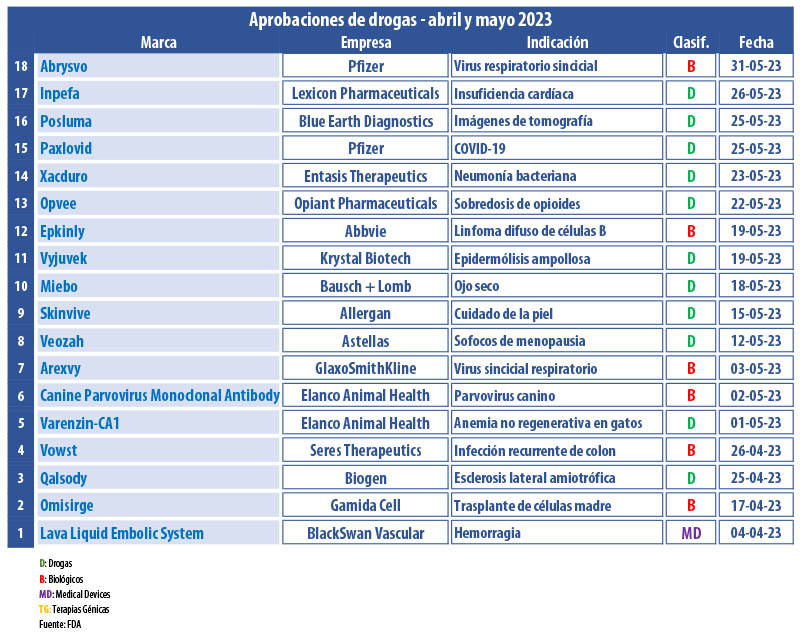
Durante los meses de abril y mayo, la FDA le dio el visto bueno a cerca de una veintena de nuevos desarrollos. La lista está compuesta por biológicos de variada gama; una tríada de productos para salud animal, entre otras novedades.
La primera mitad del año se acerca a su final, con la FDA en plena actividad. En el último mes, el regulador estadounidense le puso el pie al acelerador a sus aprobaciones.
En ese contexto resaltó una de las tecnologías que está en la cresta de ola y es la de las terapias génicas. El organismo autorizó Vyjuvek, para las heridas en mayores de seis meses con epidermólisis ampollosa distrófica, un trastorno genético que afecta el tejido conectivo en la piel y las uñas, generado por mutaciones en el gen de la cadena alfa 1 del colágeno tipo VII. Basado en el vector del virus del herpes simple tipo 1, el producto lleva el sello de la norteamericana Krystal Biotech. Ver Press Release Vyjuvek.
Además, la FDA le concedió el aval a Epkinly, a base de epcoritamab-bysp, de la norteamérica Abbvie. Es el primer anticuerpo biespecífico que interactúa con las células T, para el tratamiento de adultos con linfoma difuso de células B grandes, un tipo de linfoma de Hodgkin. El oncológico surgió mediante el programa de aprobación acelerada, para su uso después de dos o más líneas de terapias sistémicas. Ver Press Release Epkinly.
Otro producto que recibió el OK en el último bimestre fue Xacduro, indicado para la neumonía bacteriana adquirida en el hospital y la neumonía bacteriana asociada al ventilador causada por cepas susceptibles de las bacterias acinetobacter baumannii calcoaceticus. El producto es de la biotech estadounidense Entasis Therapeutics, una subsidiaria de Inoviva. Ver artículo Xacduro.
En el último día de mayo la FDA aprobó Abrysvo, una vacuna contra el virus respiratorio sincicial que lleva el sello de la norteamericana Pfizer. La dosis está indicada para la prevención de la enfermedad de las vías respiratorias inferiores causada por el RSV en personas de 60 años o más. La multi espera que el producto esté disponible en el tercer trimestre de este año. Ver press release Abrysvo.
En este bimestre, la FDA le volvió a poner la lupa a la pandemia del coronavirus, y le dio el visto bueno al antiviral Paxlovid. Se trata del cuarto medicamento, y el primero de uso oral respaldado por el regulador norteamericano para la afección de COVID-19, de leve a moderada en adultos con alto riesgo de progresión a grave. El producto, propiedad de la norteamericana Pfizer, había sido avalado al cierre del 2021 para uso de emergencia. Ver Press Release Paxlovid.
La agencia también autorizó Posluma, a base de flotufolastat F 18. El inyectable de Blue Earth Diagnostics está indicado para la tomografía por emisión de positrones de lesiones para el antígeno prostático específico de membrana (PSMA) en hombres con cáncer de próstata con sospecha de metástasis. Este es el primer agente de imágenes dirigido por PSMA. Ver Prospecto Posluma.
La FDA le dio luz verde a las gotas Miebo para el ojo seco. Es el primer tratamiento que se dirige directamente a la evaporación de las lágrimas. Además, es la primera aprobación que la canadiense Bausch + Lomb recibe para un producto de venta por prescripción, tras su separación de Bausch Health un año atrás. Ver artículo Miebo.
Al cierre del bimestre, el organismo avaló Opvee, el primer aerosol nasal de clorhidrato de nalmefeno para el tratamiento de emergencia de sobredosis de opioides en mayores de 12 años. El producto forma parte del portfolio de Opiant Pharmaceuticals, firma que fue adquirida este año por la británica Indivior. Ver Press Release Opvee.
Los japoneses de Astellas consiguieron el OK del regulador para su medicamento oral para el tratamiento de síntomas vasomotores de moderados a graves, o sofocos, causados por la menopausia. Su nombre es Veozah, y resulta el primer antagonista del receptor de neuroquinina 3 para esta indicación. Ver artículo Veozah.
A principios de mayo, la FDA le subió el pulgar a la británica GSK y a su producto Arexvy. La multi se convirtió en la primera empresa en recibir la aprobación para una vacuna contra el virus sincicial respiratorio. La misma demostró ser 82,6% eficaz para prevenir la enfermedad del tracto respiratorio inferior relacionada con el VSR en mayores de 60 años. Ver artículo Arexvy.
La estadounidense Biogen consiguió el visto bueno para Qalsody. El mismo está indicado para el tratamiento de personas con esclerosis lateral amiotrófica, también conocida como la enfermedad de Lou Gehrig, con con mutaciones en un gen específico que conduce a la acumulación de niveles tóxicos de la proteína superóxido dismutasa 1. A base de tofersen, se convirtió en la primera terapia dirigida a una causa genética de la enfermedad. Ver artículo Qalsody.
Además, la FDA le dio luz verde a una segunda terapia de trasplante fecal. Se trata de Vowst, un producto de la norteamericana Seres Therapeutics indicado para infecciones recurrentes por clostridioides difficile en mayores de 18 años. El producto, que fue designado huérfano, está basado en una bacteria viva que se produce al purificar la materia fecal donada por personas sanas. Ver artículo Vowst.
La agencia aprobó Omisirge, de la israelí Gamida Cell. Esta es una terapia celular basada en la sangre del cordón umbilical de donantes, para acelerar la recuperación de glóbulos blancos en el cuerpo y reducir el riesgo de infección. Específicamente, está indicada su uso en mayores de 12 años con cánceres de la sangre previstos para un trasplante de sangre del cordón umbilical después de un tratamiento como radiación o quimioterapia. Ver Press Release Omisirge.
En el segmento de estética, Allergan, que forma parte de la norteamericana Abbvie, recibió luz verde para Skinvive, de Juvederm. Se trata del primer inyectable intradérmico de microgotas de ácido hialurónico avalado para mejorar la piel de las mejillas. Ver artículo Skinvive.
Asimismo, la californiana BlackSwan Vascular recibió la aprobación de su desarrollo, Lava Liquid Embolic System. Este device, inyectable y no adhesivo, está indicado para la embolización de hemorragias arteriales periféricas. El sistema también incluye partículas que se pueden ver con imágenes de fluoroscopia cuando están dentro del cuerpo. Ver Press Release Lava Liquid.
En la nómina de autorizaciones también figura Inpefa, de Lexicon Pharmaceuticals. Este inhibidor oral, a base de sotagliflozina, está indicado para reducir el riesgo de muerte cardiovascular, y hospitalización o visita urgente por insuficiencia cardíaca en adultos con insuficiencia cardiaca o diabetes mellitus tipo 2, enfermedad renal crónica y otros factores de riesgo cardiovascular. Ver Press Release Inpefa.
Salud animal
La norteamericana Elanco recibió el OK para el que fue catalogado como el primer medicamento para el control de la anemia no regenerativa asociada con la enfermedad renal crónica en gatos. Se trata de Varenzin-CA1, a base de molidustat. El mismo cuenta con una aprobación condicional, válida por un año con el potencial de cuatro renovaciones anuales. Según se precisó, Varenzin-CA1 es considerado seguro, aunque resta evidencia sustancial de efectividad. Ver artículo Varenzin.
Elanco también obtuvo el respaldo para Canine Parvovirus Monoclonal Antibody, el primer anticuerpo monoclonal para el parvovirus canino, uno de los virus más contagiosos y mortales que un perro puede contraer: la tasa de mortalidad ronda el 91% si no es tratado. Esta es también una licencia condicional. Ver artículo Canine.
En la nómina también figura Librela, de la norteamericana Zoetis. Este fue descripto como el primer anticuerpo monoclonal para el control del dolor asociado con la osteoartritis en perros. Este inyectable, a base de bedinvetmab, había sido avalado un año atrás en su versión para gatos, bajo la marca Solensia. Ver artículo Librela.