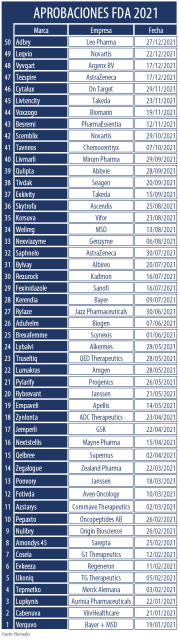
La FDA dio a conocer su clásico informe sobre lo aprobado durante todo el 2021. El organismo le dio luz verde a 50 nuevas moléculas. El año 2020 habían sido 53. Así en un bienio marcado por el COVID-19, los nuevos productos para un amplio espectro de patologías también fueron parte de la agenda.
A pesar de los desafíos y obstáculos impuestos por el coronavirus, la FDA no detuvo su ritmo de aprobaciones. De acuerdo a su tradicional informe anual, la agencia aprobó 50 nuevos tratamientos durante el 2021. Así estuvo por debajo de los 53 avalados en el 2020 y por encima de los 48 de 2019. Ver Documento.
Las autorizaciones de 2021 se enfocaron en enfermedades y condiciones como las cardíacas, sanguíneas, renales y endocrinas, incluidos los tratamientos para la diabetes, la enfermedad renal crónica y el control crónico del peso; las autoinmunes, inflamatorias y pulmonares, como la enfermedad inflamatoria intestinal y la fibrosis quística.
Por otro lado, se centraron en afecciones neurológicas, como el Alzheimer, sobredosis de opioides y migraña; enfermedades infecciosas, incluido el VIH-1, la viruela y la infección por citomegalovirus y diferentes tipos de cáncer, como cáncer de pulmón, carcinoma de células basales, cáncer de riñón, cáncer de mama y cáncer de estómago.
La FDA, que suele estar a la cabecera de todas las autoridades regulatorias globales, enfatizó además que 38 de las 50 drogas nóveles -un 76%- aprobadas durante el año pasado fueron avaladas en los Estados Unidos antes que en cualquier otro país.
El organismo destacó que, al igual que en 2020, las Enfermedades Raras fueron las estrellas. El 52% de los OKs otorgados por la FDA fueron para terapias enroladas en esta categoría. En este segmento, se destacaron fármacos para la acondroplasia; la distrofia muscular de Duchenne; la miastenia gravis generalizada y la enfermedad de Pompe. También para cánceres poco frecuentes como el colangiocarcinoma (conducto biliar); tumores asociados con la enfermedad de von Hippel-Lindau; amiloidosis de cadena ligera; tumor de células epitelioides perivasculares y el de ovario.
Por otro lado, el Centro de Evaluación e Investigación de Medicamentos (CDER) aprobó en 2021 los primeros dos biosimilares intercambiables. Se trata de productos biológicos que pueden ser sustituidos sin la intervención de un prescriptor. “Más productos biosimilares e intercambiables en el mercado significan una mayor competencia que puede conducir a un mayor acceso a las terapias y costos más bajos para los pacientes”, dijo Patrizia Cavazzoni, directora de este organismo.
La FDA también autorizó medicamentos en nuevas capacidades, ya sea para usos o poblaciones de pacientes no aprobados hasta el momento.
First in Class
El regulador consigna en su informe que 27 de los 50 nuevos productos (54%) aprobados fueron primeros en su clase. En este grupo están incluidos, por caso, Aduhelm de Biogen para el Alzheimer o Leqvio, un medicamento de Novartis que apunta al tratamiento del colesterol malo.
El listado se completa con Adbry de Leo Pharma; Besremi de PharmaEssentia; Brexafemme de Scynexis; Bylvay de Albireo; Cosela de G1 Therapeutics; Cytalux de On Target; Empaveli de Apellis; Evkeeza de Regeneron; Kerendia de Bayer; Korsuva de Vifor; Livtencity de Takeda; Lumakras de Amgen; Lupkynis de Aurinia Pharmaceuticals; Nulibry de Origin Bioscience; Rezurock de Kadmon; Rybrevant de Janssen; Saphnelo de AstraZeneca; Tavneos de Chemocentryx; Tezspire de AstraZeneca; Tivdak de Seagen; Verquvo de Bayer y MSD; Voxzogo de Biomarin; Vyvgart de Argenx BV; Welireg de MSD; y Zynlonta de ADC Therapeutics.
Oncología
El año pasado, la agencia norteamericana también le levantó el pulgar a varias terapias nuevas para uso en Oncología. ¿Lo más destacado? Se aprobaron cuatro nuevos medicamentos para el cáncer de pulmón de células no pequeñas, incluido uno para un tipo que antes se pensaba que era resistente al tratamiento. El CDER también autorizó una terapia para algunos tipos de carcinoma de células basales, la forma más común de cáncer de piel, para ciertas poblaciones de pacientes.
La agencia destacó también entre sus logros el respaldo a Opdivo, de BMS, como la primera inmunoterapia de primera línea para el cáncer de esófago; el cáncer gástrico y el adenocarcinoma de la unión gastroesofágica. En el 2021 el organismo regulatorio también aprobó algunas terapias para diversos tipos de cáncer de mama.
Informe de aprobaciones de FDA del 2020.