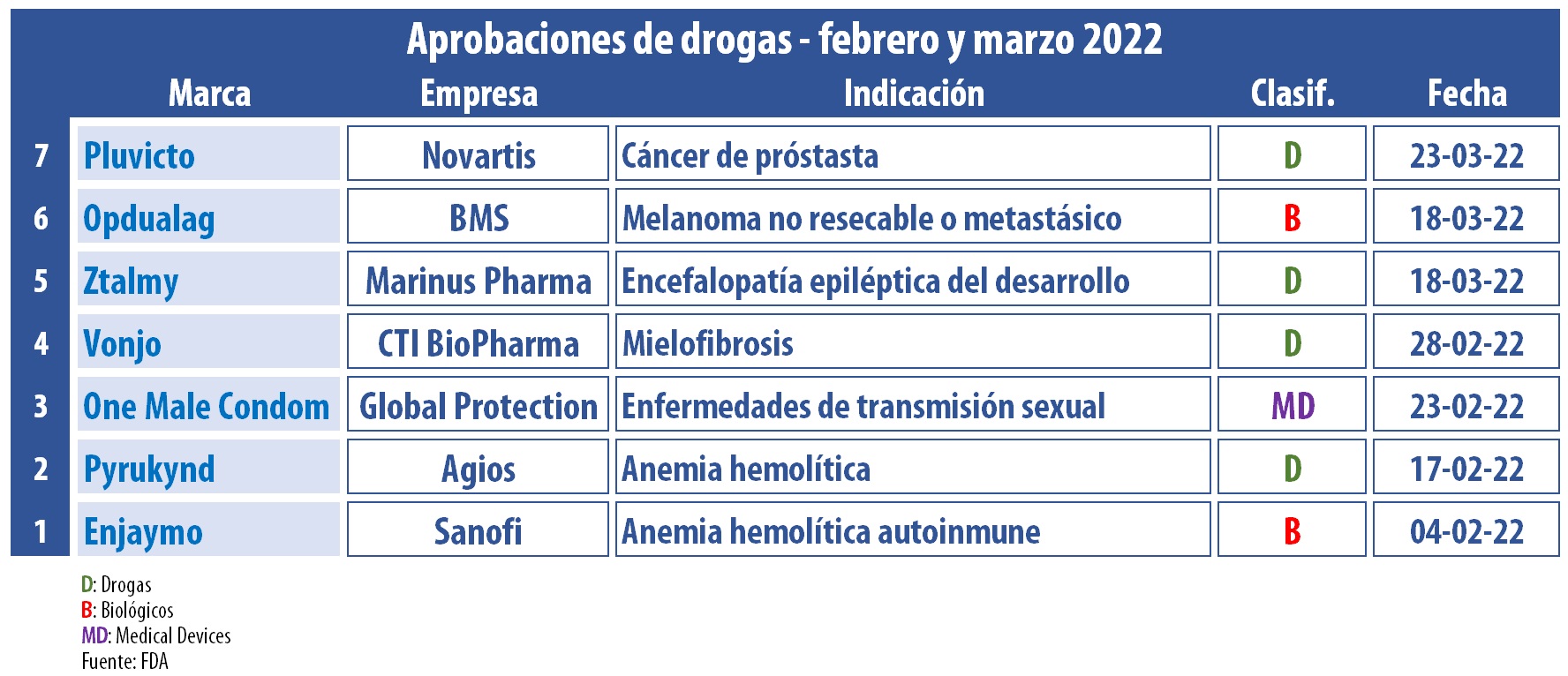
En los meses de febrero y marzo la FDA le dio el visto bueno a siete nuevos productos. Entre ellos se destacan tres oncológicos y el primer condón diseñado específicamente para relaciones sexuales anales.
La FDA bajó su ritmo de aprobaciones en el segundo y en el tercer mes de este 2022. Por caso, durante el bimestre, el organismo regulatorio avaló un conjunto de siete tratamientos.
La agencia norteamericana le levantó el pulgar a Opdualag, de la estadounidense BMS, indicado para mayores de 12 años con melanoma no resecable o metastásico. Este biológico resulta una combinación de los anticuerpos relatlimab y nivolumab. Fue desarrollado en el marco del Proyecto Orbis, que el organismo impulsa desde el 2019. Ver Press Release FDA // Ver Press Release BMS
Además, la FDA le dio luz verde a Pluvicto, un nuevo medicamento que lleva el sello de la suiza Novartis. Se trata de la primera terapia de radioligando para adultos con cáncer de próstata metastásico resistente a la castración. La misma combina un compuesto dirigido –ligando- con un radioisótopo terapéutico -una partícula radioactiva-. Ver artículo Novartis
La FDA también respaldó a Enjaymo, de la francesa Sanofi, el que apunta a disminuir la necesidad de transfusiones de glóbulos rojos generada por hemólisis en adultos con enfermedad de las aglutininas frías -CAD, por sus siglas en inglés-. El biológico, a base de sutimlimab, se constituye en el primer y único tratamiento aprobado para este raro tipo de anemia hemolítica autoinmune. Ver Press Release Sanofi
En sintonía, el organismo le dio el visto bueno a las tabletas Pyrukynd, desarrolladas por la norteamericana Agios, a base de mitapivat. Las mismas están indicadas para anemia hemolítica en adultos con deficiencia de piruvato quinasa (PK). De acuerdo con la firma, este es el primer activador oral de PK de su tipo y la primera terapia modificadora avalada para esta enfermedad. Ver Press Release FDA // Ver Press Relase Agios
Otro que obtuvo la venia en este bimestre fue Ztalmy. Este producto, que lleva el sello de la estadounidense Marinus Pharma, fue catalogado como el primer tratamiento para convulsiones asociadas con el trastorno por deficiencia (CDD) de la quinasa similar a la 5 dependiente de ciclina (CDKL5) en mayores de dos años. Según lo especificado, CDD es una rara encefalopatía epiléptica del desarrollo, causada por mutaciones en el gen CDKL5. Ver Press Release FDA // Ver Press Release Marinus
Por otro lado, la norteamericana CTI BioPharma alcanzó el OK para Vonjo, a base de pacritinib. El mismo está indicado para adultos con mielofibrosis -un tipo raro de cáncer de médula ósea– que además presenten una cantidad anormalmente baja de plaquetas en sangre. Vonjo fue aprobado mediante vía rápida, a la vez que recibió la designación de droga huérfana. Ver Press Release FDA // Ver Press Release CTI
En el wing de los medical devices, la FDA autorizó la comercialización de los primeros condones específicamente diseñados para reducir la posibilidad de contagio de infecciones de transmisión sexual (ITS) durante relaciones sexuales anales. Los preservativos, que salen bajo la marca One Male Condom, también están avalados como anticonceptivos para minimizar el riesgo de embarazo en relaciones vaginales. Ver Press Release FDA