El organismo regulatorio estadounidense le dio el OK a una terapia génica, entre otros nuevos productos, en el mes de noviembre. A poco de concluir el año, no se pierde el ritmo de aprobaciones.
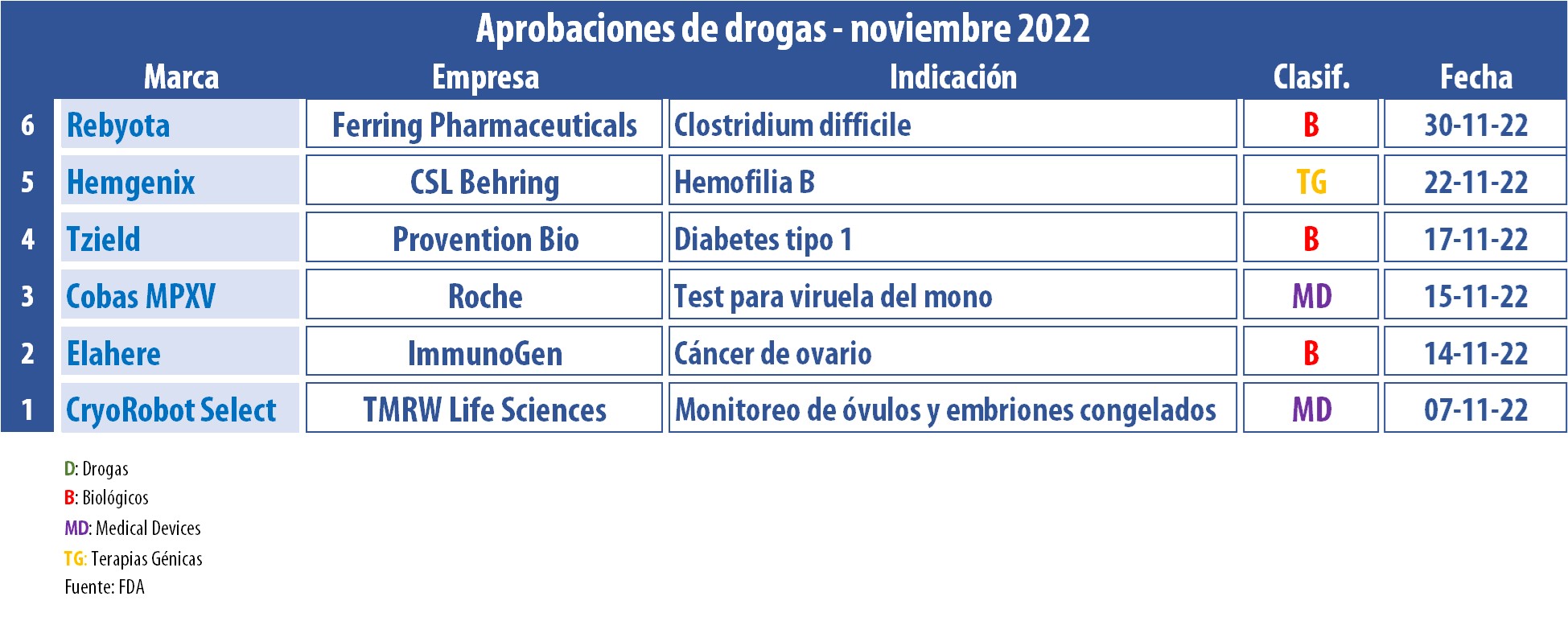
En el penúltimo mes del año, la FDA siguió súper activa en materia de aprobaciones. En lo que va del 2022, ya respaldó a más de 40 nuevos productos, entre los que se listan biológicos, drogas y medical devices.
En este noviembre, la agencia autorizó la primera terapia génica para la hemofilia B en adultos. Se trata de Hemgenix, la que lleva el sello de la biotecnológica australiana CSL Behring. Mientras que, hasta entonces, los pacientes solían requerir una rutina de aplicaciones intravenosas de medicamentos que reemplacen el factor IX, Hemgenix surge como un producto basado en vectores de virus adenoasociados, que requiere de una única aplicación y que se convierte en una solución a largo plazo. Ver artículo.
El segmento de Onco permanece también fuerte dentro de la agenda de la FDA. Este mes, el organismo le dio el OK a Elahere, para cáncer epitelial de ovario, de trompas de falopio o peritoneal primario, con receptor de folato alfa (FRα) positivo y resistente al platino. De acuerdo con la estadounidense ImmunoGen, este es el primer conjugado de anticuerpos y fármacos de su tipo e indicado para quienes han recibido de uno a tres regímenes de tratamiento sistémico previos. Ver Press Release.
Otro que obtuvo luz verde en este período fue Tzield, de la estadounidense Provention Bio. Se trata de un inyectable a base de teplizumab, que apunta a retrasar la aparición de la diabetes tipo 1 en etapa 3 en mayores de ocho años. Según la compañía, este biológico puede desactivar las células inmunitarias que atacan a las células productoras de insulina, mientras aumenta la proporción de células que ayudan a moderar la respuesta inmunitaria. Ver Press Release.
En tanto, en el wing de los devices, la FDA le sigue dando cuerda a sus primeros avales para los diagnósticos para la viruela del mono. El organismo emitió una autorización de uso de emergencia a la suiza Roche para Cobas MPXV, el tercer test de este tipo. El mismo está indicado para la detección cualitativa de ADN del virus en humanos, a través de muestras de exudado de lesiones. Ver artículo.
A su vez, la agencia le dio el visto bueno a CryoRobot Select, el que fue desarrollado por la estadounidense TMRW Life Sciences, especializada en fertilidad. De acuerdo con la multi, CryoRobot Select es la única solución automatizada que rastrea, monitorea y administra digitalmente óvulos y embriones congelados utilizados en fertilización in vitro. Ver Press Release.
Asimismo, el último día del mes el regulador le dio luz verde a Rebyota, una terapia basada en trasplantes fecales, indicada para reducir la recurrencia de la infección bacteriana Clostridium difficile. El producto, de la suiza Ferring, se convirtió en la primera terapia de este tipo avalada en los Estados Unidos. Ver artículo.