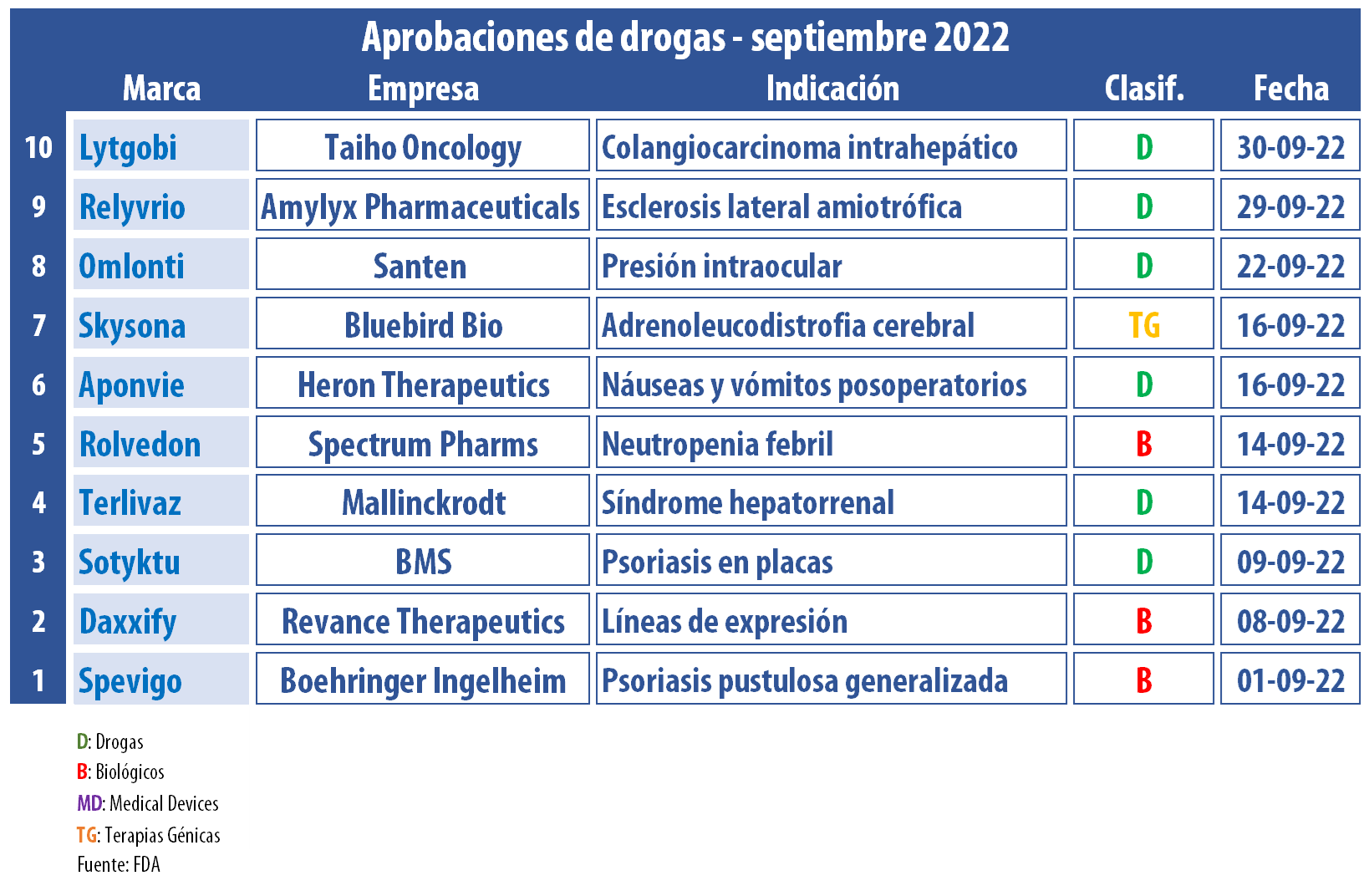
El organismo regulatorio estadounidense aceleró su ritmo de aprobaciones. En este noveno mes del año, la FDA le levantó el pulgar a una decena de nuevos productos.
En este mes de septiembre, la FDA respaldó una decena de nuevos productos. Indicados para un amplio abanico de enfermedades, seis de ellos quedaron catalogados como los primeros de su tipo.
El organismo regulatorio norteamericano le dio luz verde a una nueva terapia génica. Se trata de Skysona, de la estadounidense Bluebird Bio, para la adrenoleucodistrofia cerebral activa temprana que, considerada neurodegenerativa rara y progresiva, afecta principalmente a niños y causa un deterioro irreversible. Según la compañía, este es el único medicamento que demostró retrasar la progresión de la disfunción neurológica. La firma fijó el costo de adquisición mayorista en u$s 3 millones, de modo que rankea como el más caro del mundo. Ver artículo.
Además, la FDA avaló Relyvrio, de la estadounidense Amylyx Pharmaceuticals, una terapia combinada oral de dosis fija para la esclerosis lateral amiotrófica. También conocida como enfermedad de Lou Gehrig por el jugador de baseball fallecido en 1941, la misma es de carácter progresivo y potencialmente mortal, en tanto ataca y destruye las células nerviosas que controlan los músculos voluntarios. En junio pasado, el ex senador Esteban Bullrich, quien padece de ELA, manifestó que solicitaría la autorización por parte de la ANMAT, aunque luego desde el organismo indicaron que ningún laboratorio presentó información para su evaluación. Ver artículo.
En este periodo, la agencia también le dio el visto bueno a Daxxify, de la estadounidense Revance Therapeutics. Este neuromodulador inyectable, que apunta a convertirse en un rival de Botox, la popular toxina botulínica que la norteamericana AbbVie heredó de Allergan, fue consignado como el primero basado en tecnología de intercambio de péptidos. Según Revance, Daxxify puede reducir las líneas de expresión entre las cejas durante seis meses, casi el doble de tiempo que Botox. Ver artículo.
A su vez, la FDA respaldó Sotyktu, una marca que le llegó a la estadounidense BMS tras la adquisición de Celgene en el año 2019. Este inhibidor de tirosina quinasa 2, fabricado a base de deucravacitinib e indicado para la psoriasis en placas, competirá con los inyectables Humira, de AbbVie, y Enbrel, de Amgen. De acuerdo con la multi, Sotyktu tiene el potencial para convertirse en el nuevo standard de tratamiento oral. para esta enfermedad. Ver artículo.
Otro que recibió el OK en este septiembre fue Spevigo, de la alemana Boehringer Ingelheim. Se trata de un anticuerpo monoclonal selectivo que bloquea la activación del receptor de la interleucina-36 (IL-36R). Según la corporación, este es el primer tratamiento para los brotes de psoriasis pustulosa generalizada, un trastorno de la piel raro y potencialmente mortal. Ver artículo.
Asimismo, la agencia le levantó el pulgar a Lytgobi, de la japonesa Taiho Oncology, subsidiaria de Otsuka Holdings, enfocada en oncológicos. Lytgobi está indicado para adultos con colangiocarcinoma intrahepático previamente tratado, irresecable, localmente avanzado o metastásico que alberga el gen del receptor 2 del factor de crecimiento de fibroblastos (FGFR2) fusiones u otros reordenamientos. Ver Press Release.
Entre los avales de este mes también se encuentra Terlivaz, de la estadounidense Mallinckrodt. Este inyectable es el único con el OK de la FDA para mejorar la función renal en adultos con síndrome hepatorrenal, el cual es común en personas con cirrosis avanzada y ascitis, una acumulación anormal de líquido en el abdomen que a menudo se relaciona con una enfermedad hepática. Ver Press Release Terlivaz.
En paralelo, además, la FDA respaldó Roldevon, de la californiana Spectrum Pharmaceuticals, para disminuir la incidencia de infección manifestada por neutropenia febril en adultos con neoplasias malignas no mieloides que reciben fármacos anticancerosos mielosupresores. De acuerdo con la firma, este inyectable es el primer factor estimulante de colonias de granulocitos (G-CSF) de acción prolongada aprobado en más de 20 años. Ver Press Release Spectrum.
También en septiembre, la agencia autorizó la emulsión inyectable Aponvie, a base de aprepitant, de la biotecnológica estadounidense Heron Therapeutics. Según la empresa, esta es la única formulación intravenosa de un antagonista del receptor de la sustancia P/neuroquinina-1 (NK1) indicado para la prevención de náuseas y vómitos posoperatorios. Ver Press Release Heron
La lista de aprobaciones se completa con las gotas Omlonti, desarrolladas de forma conjunta por la japonesa Santen Pharmaceutical y por UBE Corporation. Se trata de una solución oftálmica para la reducción de la presión intraocular elevada en personas con glaucoma primario de ángulo abierto o hipertensión ocular. El principio activo de Omlonti, isopropilo de omidenepag, fue catalogado como un agonista del receptor de prostaglandina EP2 relativamente selectivo, y el único producto con esta acción farmacológica. Ver Press Release Santen.