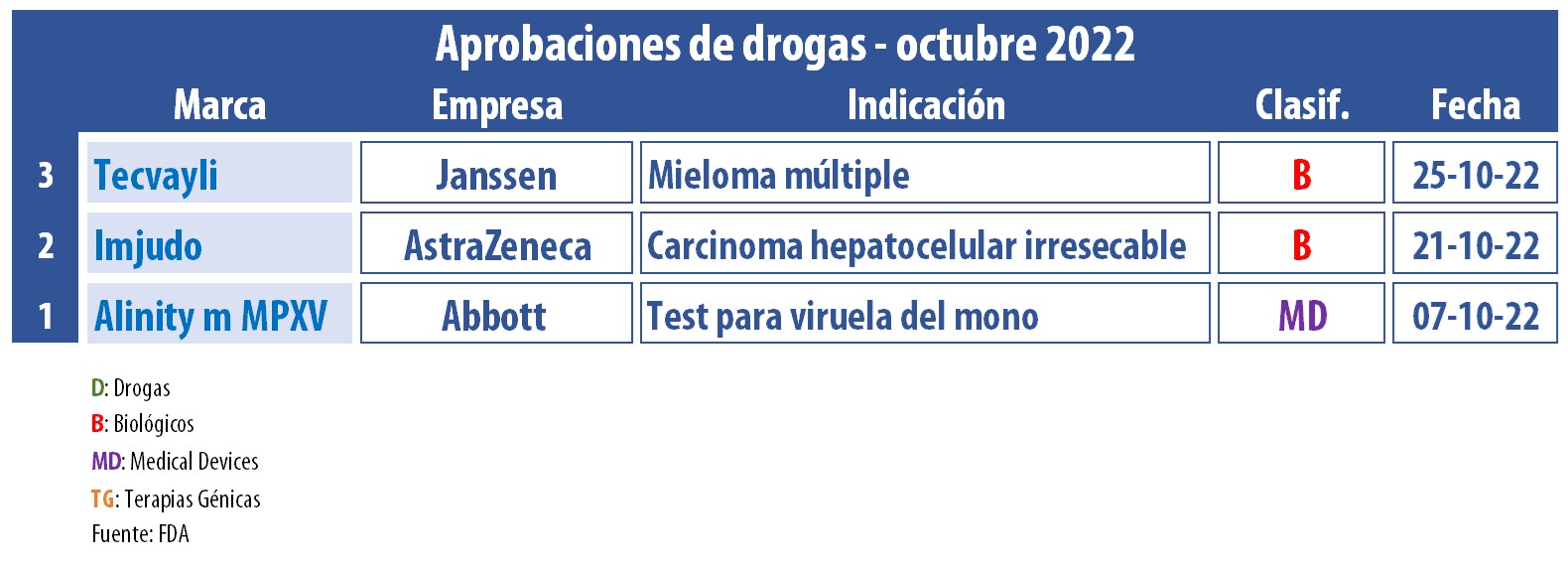
El organismo regulatorio estadounidense generó nuevas aprobaciones durante este mes que acaba de cerrar. Le dio el visto bueno a tres productos, dos de ellos para uso en oncología.
En este décimo mes del año, la FDA le dio el OK al primer anticuerpo biespecífico activador de células T para el tratamiento del mieloma múltiple en recaída o refractario. Se trata de Tecvayli, el que lleva el sello de la estadounidense Janssen. Este inyectable está indicado para quienes ya recibieron cuatro o más líneas de terapia, incluido un inhibidor del proteasoma, un fármaco inmunomodulador y un anticuerpo monoclonal anti-CD38.1. Ver artículo.
Otro que obtuvo el visto bueno de la FDA fue Imjudo, de la británica AstraZeneca, para el carcinoma hepatocelular irresecable, el tipo más común de cáncer de hígado. Desarrollado a base de tremelimumab, este biológico fue avalado para su uso en combinación con el anticuerpo monoclonal Imfinzi, compuesto por durvalumab, el que ya había sido autorizado en el 2017. Ver artículo.
En el wing de los devices, la FDA le dio luz verde al segundo test de PCR para la viruela del mono. El mismo fue bautizado como Alinity m MPXV por la norteamericana Abbott y, de acuerdo a lo comunicado, permite detectar el virus en tiempo real. Un mes atrás, la FDA había respaldado la primera prueba de este tipo, bajo el paraguas de Quest Diagnostics. Ver artículo.