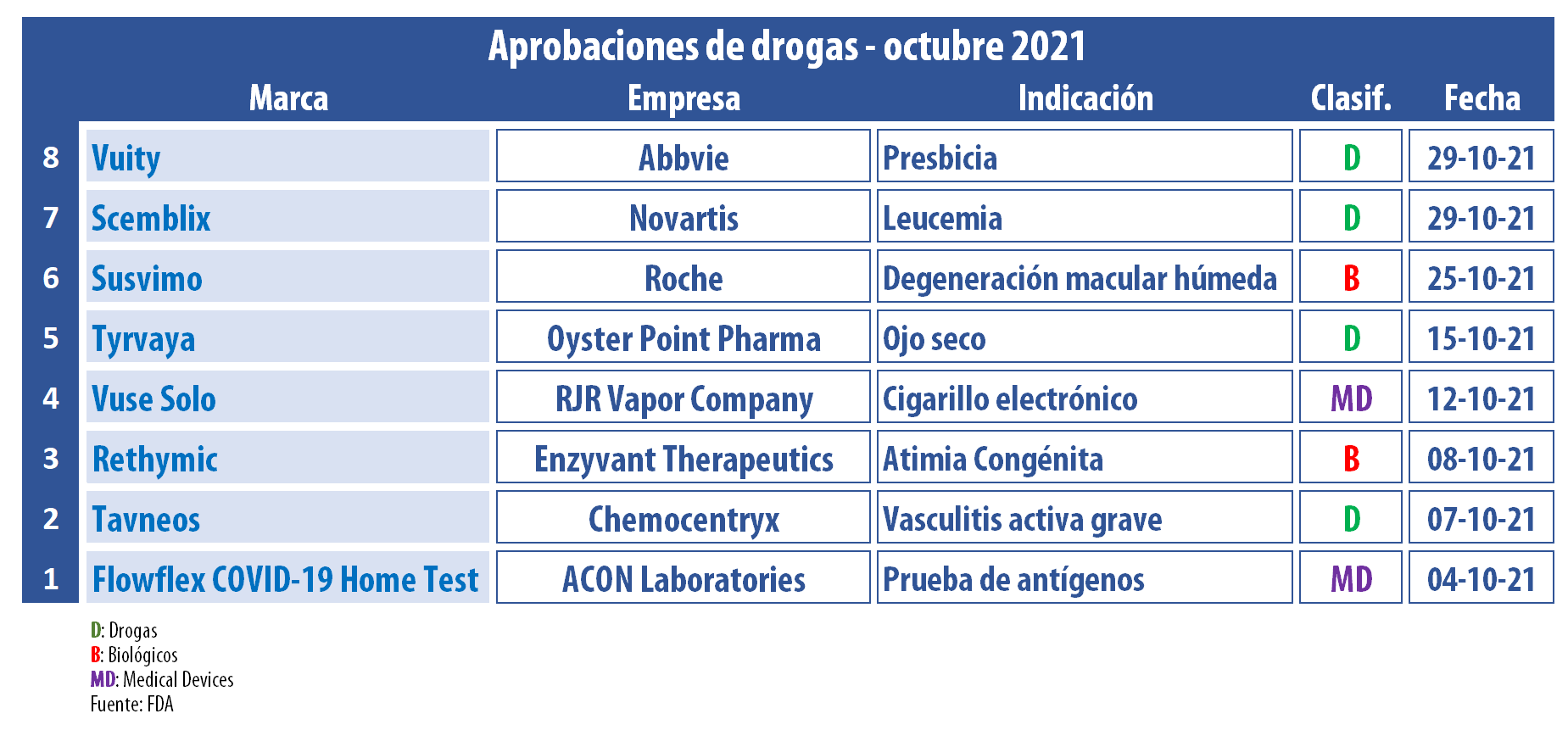
En el décimo mes del año, la FDA aprobó una amplia variedad de productos. Entre ellos se destacan un oncológico de la suiza Novartis, un tratamiento ocular de la suiza Roche; y un spray para ojo seco. También se llevaron el OK un medicamento para una enfermedad pediátrica rara; y un test hogareño para el COVID-19, entre otros.
En este octubre de 2021, la FDA le levantó el pulgar a un nuevo oncólogico de la suiza Novartis. Se trata de Scemblix, indicado para personas con leucemia mieloide crónica con cromosoma Filadelfia positivo que hayan recibido dos o más tratamientos con inhibidores de la cinasa tirosina, y también para aquellas con la mutación T315I. Ver «FDA aprueba Scemblix, Novartis».
Además, la agencia le dio luz verde a Susvimo, de la suiza Roche, un biológico para la degeneración macular neovascular o «húmeda» (nAMD) relacionada con la edad. De acuerdo a lo detallado por la multi, es la primera terapia aprobada en 15 años como alternativa a los inyectables standard que suelen ser requeridos de forma mensual. Este producto está indicado para uso intravítreo mediante un implante ocular recargable que requiere de sólo dos aplicaciones por año. Ver Press Release.
En tanto, la norteamericana Oyster Point Pharma consiguió el visto bueno de la FDA para Tyrvaya, un spray nasal en base a solución de vareniclina, que apunta al tratamiento de los signos y síntomas de la enfermedad de ojo seco. Así se constituye en el primer y único spray nasal para dicha indicación en ser avalado por la agencia regulatoria. Ver «FDA aprueba Tyrvaya, ojo seco».
Para la salud ocular también surgió Vuity, un producto desarrollado por Allergan y que ahora pertenece a la norteamericana Abbvie. El mismo es definido como la primera y única gota ocular para tratar la presbicia. Este colirio de prescripción hace efecto en 15 minutos y el mismo dura hasta 6 horas. Apunta a mejorar la visión de cerca e intermedia sin afectar la visión de lejos. Vuity es una fórmula optimizada de pilocarpina, un tratamiento terapéutico establecido para el cuidado de los ojos, que se apoya en la tecnología pHast. Ver Press Release.
En octubre, el organismo regulador le dio luz verde a Rethymic, enrolado en el segmento de enfermedades pediátricas raras. Se trata de una nueva terapia regenerativa que se utiliza para la reconstitución inmunitaria en niños con atimia congénita. Rethymic, el primer producto de tejido de timo aprobado en Estados Unidos, lleva el sello de la norteamericana Enzyvant Therapeutics. Ver Press Release.
Otro que ganó un OK en este mes fue Tavneos, de la norteamericana ChemoCentryx. A base de avacopan, fue respaldado como complemento a la terapia standard, la que incluye glucocorticoides, para adultos con vasculitis activa grave asociada a autoanticuerpos anti-citoplasma de neutrófilos. De acuerdo con la firma, este es el primer inhibidor del receptor del complemento 5a administrado por vía oral que obtuvo un guiño de la agencia. Ver Press Release FDA / Ver Press Release ChemoCentryx.
En el wing de los medical devices, la FDA emitió una autorización de uso de emergencia (EUA) para Flowflex COVID-19 Home Test, de la norteamericana ACON Laboratories. Se trata de una prueba de antígenos de venta libre, que se suma a la creciente lista de tests hogareños avalados por la FDA y que no requieren prescripción médica. Ver Press Release.
Además el organismo regulatorio aprobó la comercialización de un set de tres nuevos productos en base a tabaco. El mismo es el primer sistema de suministro de nicotina electrónico (ENDS) en ser autorizado por la agencia mediante la vía de solicitud de productos de tabaco antes de la comercialización, la Pre Market Tobacco Product Application (PMTA). La firma que recibió el visto bueno fue RJ Reynolds Vapor Company, empresa que forma parte de la British American Tobacco, y el dispositivo lleva el nombre de Vuse Solo. Ver Press Release FDA.