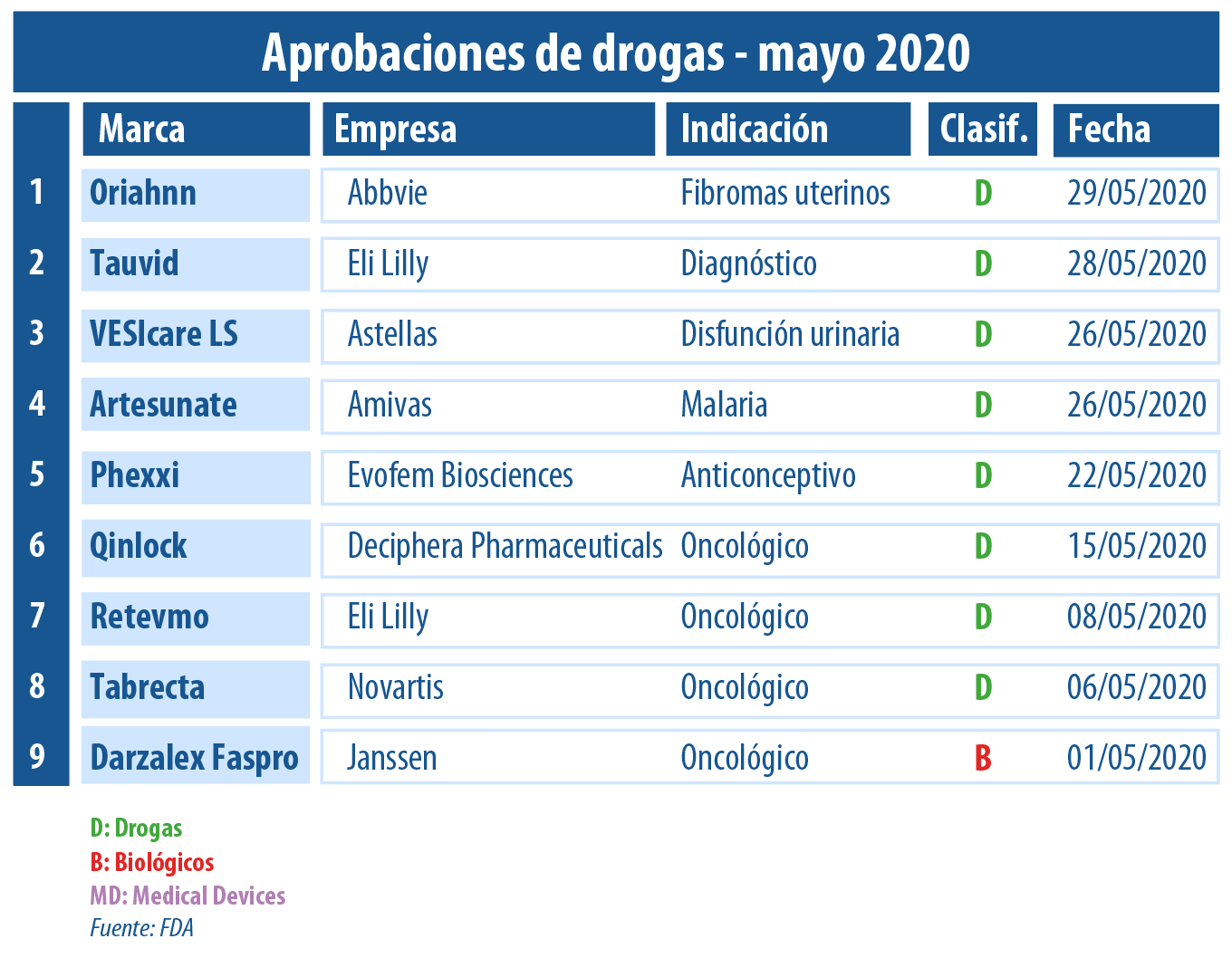
En este mayo de pandemia, el checklist de aprobaciones de la FDA no tuvo pausa. A lo largo de este mes, los oncológicos llevaron la batuta, con cuatro novedades de este tipo autorizadas.
En este mayo marcado por la crisis del coronavirus, la FDA no frenó su ritmo de aprobaciones de productos extra COVID-19. Según el relevamiento propio realizado por Pharmabiz, se registraron al menos ocho avales de nuevos medicamentos.
En este quinto mes del año, los oncológicos fueron los protagonistas. Por caso, la agencia regulatoria autorizó a Darzalex Faspro un biológico que lleva el sello de la norteamericana Janssen. El medicamento está indicado para adultos con mieloma múltiple recientemente diagnosticado o refractario. Ver Press Release.
El segundo en ser respaldado fue Tabrecta de la suiza Novartis, un tratamiento para el cáncer de pulmón de células no pequeñas que se ha diseminado hacia otras partes del cuerpo. Así se convirtió en la primera terapia dirigida a este tipo de cáncer con mutaciones específicas. Ver artículo.
Pero, no todo fue oncológicos. Por caso, la agencia le dio el OK a dos productos enrolados en el segmento de salud femenina. Por un lado avaló a Phexxi, un anticonceptivo en gel que lleva el sello de la norteamericana Evofem Biosciences; y por otro a Oriahnn de la también norteamericana Abbvie, que apunta a tratar el sangrado menstrual abundante relacionado con fibromas uterinos.
Otro en recibir el visto bueno fue Retevmo de Loxo Oncology, una empresa que forma parte de la norteamericana Eli Lilly. Consiste en un producto a base de selpercatinib, para el cáncer de pulmón de células no pequeñas y para dos subtipos de cáncer de tiroides. Ver artículo.
Asimismo, la FDA le levantó el pulgar a Qinlock, el que lleva el sello de la norteamericana Deciphera Pharmaceuticals. Es el primer tratamiento de cuarta línea en ser avalado específicamente para tumores del estroma gastrointestinal avanzados -GIST, en personas que hayan recibido tres o más terapias previas.Ver artículo.
Además, la agencia de dio el visto bueno a Phexxi, un anticonceptivo en gel propiedad de la norteamericana Evofem Biosciences. Es el primer anticonceptivo no-hormonal aprobado por el organismo regulatorio en casi tres décadas. El último había sido el preservativo femenino, que fue avalado en 1993. Otra molécula destinada a la salud femenina en ser autorizada fue Oriahnn de la norteamericana Abbvie. Se trata de un medicamento que combina estrógeno y progestina recomendado para el sangrado menstrual abundante relacionado con fibromas uterinos en mujeres premenopáusicas. Ver artículo. Ver artículo.
En este mes de mayo la FDA también le concedió la venia a un nuevo producto para la malaria grave de Amivas, un joint venture australiano, canadiense y norteamericano creado en 2016. La novedad, a base de artesunato inyectable, está indicada en adultos y niños y se convierte en el único tratamiento disponible en los Estados Unidos, desde que se discontinuó la comercialización de la quinidina en marzo del año pasado. Ver artículo.
Por otra parte, el organismo le dio el OK a VESIcare LS de la japonesa Astellas para una forma de disfunción de la vejiga relacionada con el deterioro neurológico en niños. El mismo se constituye como el primer medicamento para tratar esta condición a partir de los dos años de edad, ya que en 2004 había recibido luz verde únicamente para adultos mayores de 18 años. Ver press release.
Finalmente, sobre el filo del cierre del mes, la FDA le otorgó el visto bueno a Tauvid de la norteamericana Avid Radiopharmaceuticals, una empresa que Eli Lilly adquirió a fines del 2010. Es un agente de diagnóstico radioactivo usado en tomografías por emisión de positrones -PET- para el Alzheimer. Ver artículo.