En el sexto mes del año, la FDA le dio el OK a cuatro nuevos tratamientos. Así cierra el primer semestre con un total de 23 productos avalados, entre los que se listan biológicos, drogas y devices.
La agencia regulatoria norteamericana le dio la venia a cuatro nuevos tratamientos durante el mes de junio, tres de los cuales fueron considerados los primeros de su tipo.
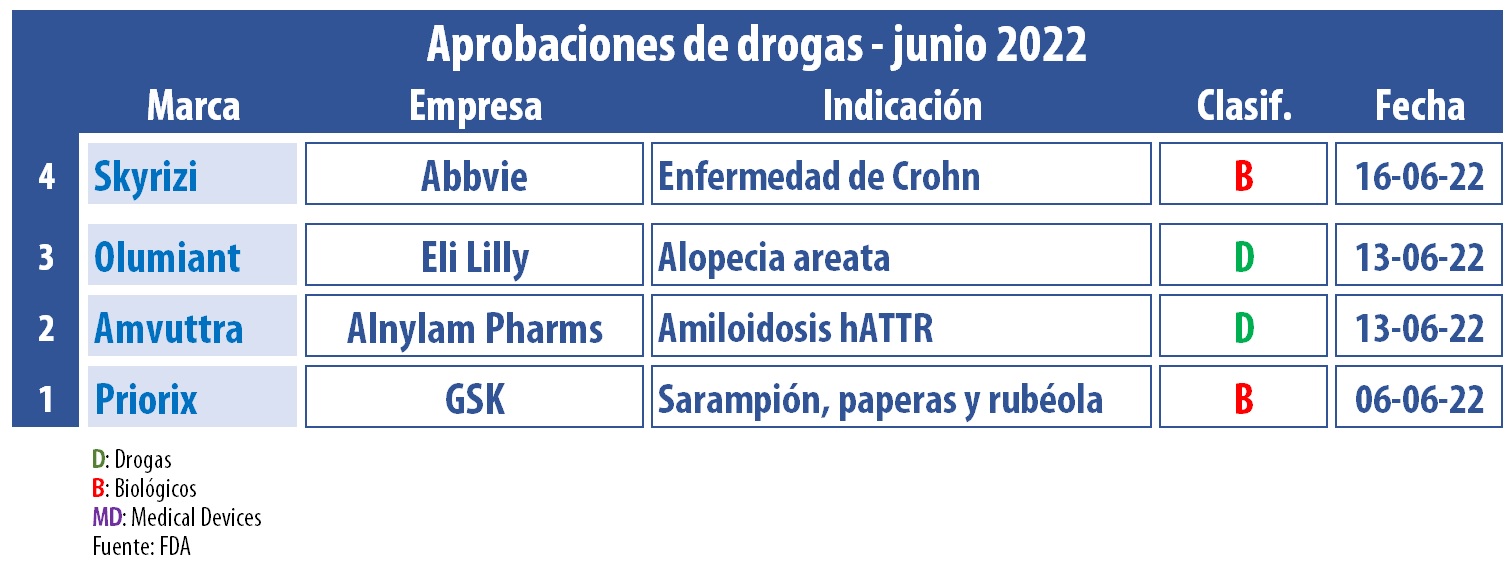
La FDA le dio luz verde a la vacuna Priorix, de la británica GSK, para la prevención del sarampión, las paperas y la rubéola en mayores de un año. Actualmente, este producto tiene licencia en más de 100 mercados, y más de 800 millones de dosis fueron distribuidas hasta la fecha. Ver OK a Priorix.
Durante este mes, el organismo le otorgó también el visto bueno a Amvuttra, de la norteamericana Alnylam. Se trata de un RNAi terapéutico, a base de vutrisiran y de administración subcutánea trimestral, para la polineuropatía de la amiloidosis hereditaria mediada por transtiretina en adultos. Según la firma, Amvuttra es la primera terapia que demuestra la reversión del deterioro de esta enfermedad rara, hereditaria, progresiva y mortal. Ver Press Release Alnylam.
Otro que recibió el OK fue Olumiant, a base de baricitinib, bajo la presentación de tabletas orales. El producto lleva el sello de la norteamericana Eli Lilly, cuyo portafolio es representado en la Argentina por el nacional Raffo. Fue catalogado como el primer tratamiento sistémico para adultos con alopecia areata severa, un trastorno que a menudo se manifiesta como calvicie irregular y afecta a más de 300 mil personas en Estados Unidos cada año. Ver Press Release FDA
A la lista de aprobaciones se sumó Skyrizi, de la estadounidense Abbvie. Este biológico inyectable, que había sido respaldado por primera vez en el 2019, fue consignado como la primera interleucina-23 específica (IL-23) para la enfermedad de Crohn activa de moderada a grave. Skyrizi está indicado, además, para la psoriasis en placas, así como para la artritis psoriásica activa. Ver Press Release Abbvie.