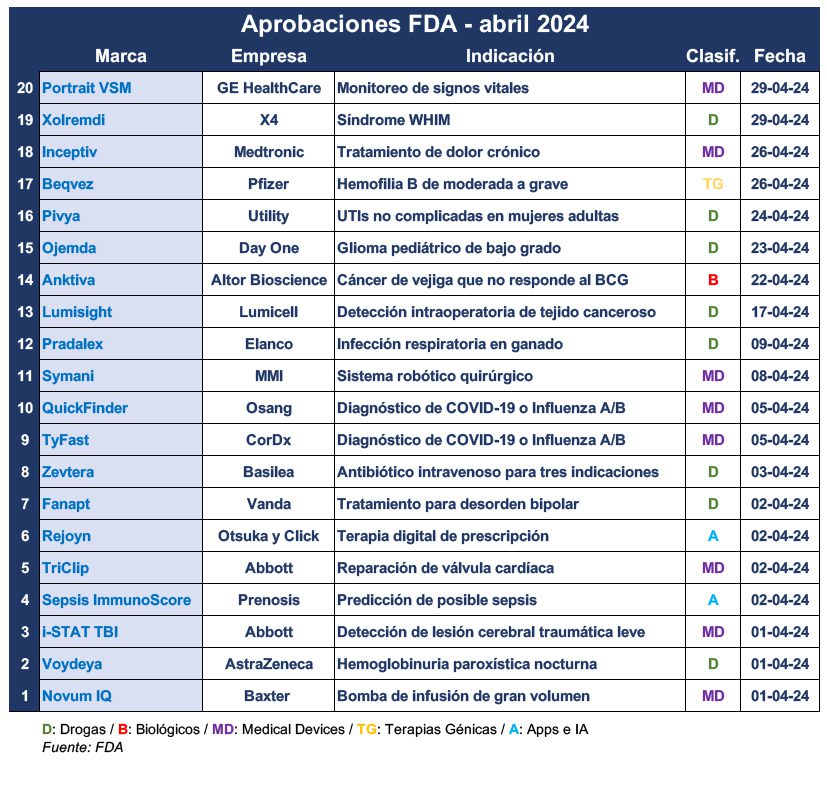
Durante el cuarto mes del año, la FDA le dio el visto bueno a dos decenas de nuevos productos. La lista incluye la primera terapia a través de app de celular aprobada por el organismo, dos tests caseros para distinguir COVID-19 de influenza, y un tratamiento para el tipo más común de tumor cerebral pediátrico.
Una vastísima y variopinta gama de medicamentos y devices recibió el aval de la FDA durante el cerrado mes de abril. Pharmabiz realiza un resumen de todo el listado de aprobaciones realizado.
La FDA le otorgó a la norteamericana Baxter luz verde para su bomba de infusión de gran volumen Novum IQ con el software de seguridad Dose IQ. El dispositivo permite a los médicos utilizar un sistema único e integrado en una variedad de entornos de atención. Baxter asegura que la experiencia de usuario integrada ayuda a reducir la carga de tareas no críticas, lo que permite centrarse más en la atención al paciente. Ver FDA aprueba Novum IQ
La agencia regulatoria aprobó Voydeya, una terapia oral complementaria de la británica AstraZeneca para tratar a pacientes con la enfermedad rara hemoglobinuria paroxística nocturna, o HPN, con hemólisis extravascular. AZ obtuvo el producto en su adquisición de Alexion por u$s 39.000 millones en el 2021. Dos años antes, Alexion había adquirido el producto mediante su compra de otra empresa de Connecticut, Achillion, por u$s 930 millones. Ver FDA aprueba Voydeya
El laboratorio estadounidense Abbott recibió el aval de la FDA para TriClip, su dispositivo de reparación de válvulas cardíacas para pacientes con insuficiencia tricúspide, una enfermedad potencialmente mortal. La luz verde llega solo un mes después de la de Evoque de Edwards, un dispositivo que reemplaza a la válvula tricúspide. Ver FDA aprueba TriClip
La FDA le levantó el pulgar para la comercialización al cartucho Abbott Point of Care i-STAT TBI, un diagnóstico in vitro para evaluar casos de sospecha de lesión cerebral traumática leve. La prueba se ejecuta con el instrumento portátil i-STAT Alinity, al lado de la cama del paciente y en 15 minutos. El aval amplía la oferta de pruebas de TBI de Abbott, que incluye la i-STAT TBI Plasma, la ARCHITECT y la prueba de laboratorio Alinity i de suero y plasma. Ver FDA aprueba test de Abbott
Otra novedad es Rejoyn, la primera terapia digital con prescripción aprobada por la FDA, para tratar la depresión severa. Desarrollada por la japonesa Ostuka, funciona desde una app de smartphone como un tratamiento de seis semanas diseñado para ayudar a mejorar el control cognitivo de las emociones a través de una combinación de ejercicios de entrenamiento cognitivo-emocional validados clínicamente. Ver Press Release de Ostuka
La norteamericana Vanda consiguió un nuevo aval para sus tabletas Fanapt, utilizadas desde el 2009 para el tratamiento agudo de pacientes con esquizofrenia. A base de iloperidona, ahora Fanapt también está indicado para el manejo de episodios maníacos o mixtos asociados con el trastorno bipolar I en adultos. Ver Press Release
Por otro lado, la FDA aprobó Zevtera, el nuevo antibiótico del laboratorio suizo Basilea Pharmaceutica. A base de ceftobiprol, el producto intravenoso está indicado para tratar tres enfermedades bacterianas: la bacteriemia por Staphylococcus aureus, las infecciones bacterianas agudas de la piel y las estructuras de la piel y la neumonía bacteriana adquirida en comunidad. Ver FDA aprueba Zevtera
El software Sepsis ImmunoScore de la estadounidense Prenosis recibió también el visto bueno. Este programa funciona con inteligencia artificial y aprendizaje automático, utilizando datos del historial médico electrónico del paciente, junto con hallazgos de laboratorio y evaluaciones clínicas, en pos de evaluar el riesgo de presencia o progresión de sepsis dentro de las 24 horas. Sepsis ImmuniScore no debe utilizarse como única base para determinar la presencia de sepsis.
En cuanto a herramientas de autodiagnóstico, la FDA concedió autorizaciones de uso de emergencia para dos pruebas destinadas a diferenciar entre el COVID y la gripe. La primera es TyFast Flu A/B & COVID-19 de CorDx, una empresa de California. Este test rápido en casa, de un solo uso, determina un resultado en personas con signos y síntomas de infección respiratoria compatibles con COVID-19 dentro de los primeros cinco días desde la aparición de los mismos, cuando se realizan pruebas al menos dos veces en tres días con al menos 48 horas entre cada una. La segunda es QuickFinder COVID-19/Flu Antigen Self Test de la coreana Osang, autorizada para personas con signos y síntomas de infección respiratoria compatibles con el COVID-19 dentro de los primeros cuatro días, siguiendo los mismos parámetros. Ver FDA aprueba dos diagnósticos COVID/gripe
La FDA autorizó la comercialización «de novo» para el sistema quirúrgico Symani de la norteamericana Medical Microinstruments, o MMI. Este es un sistema robótico para la manipulación de tejidos blandos en microcirugía, una técnica que implica una intrincada reconexión de vasos para restaurar el flujo sanguíneo o redirigir fluidos durante la reconstrucción o reparación, e incluye una función de escala de movimiento que reduce los movimientos del cirujano. Ver FDA aprueba Symani
Otro medicamento que recibió el aval de la FDA fue Lumisight, de la norteamericana Lumicell. Se trata de un producto para imágenes fluorescentes que puede ayudar en la detección de tejido canceroso después de una lumpectomía. A base de pegulicianina, el inyectable está indicado para el uso con el sistema de visualización directa Lumicell u otro dispositivo de imágenes de fluorescencia aprobado por la FDA para esta cirugía. Ver FDA aprueba Lumisight
La empresa estadounidense ImmunityBio logró la aprobación de Anktiva, su inmunoterapia combinada para cáncer de vejiga no invasiva muscular que no responde al BCG. Designada como terapia innovadora, el producto activa el sistema inmunológico de dos tipos de glóbulos blancos que combaten enfermedades, las células T asesinas y las células asesinas naturales, para atacar las células tumorales. La FDA la había rechazado el año pasado por deficiencias encontradas durante la inspección de empresas de fabricación por contrato. Ver FDA aprueba Anktiva
Pivya, de la norteamericana Utility Therapeutics, recibió el OK de la FDA. El producto fue aprobado para el tratamiento de infecciones del tracto urinario no complicadas en mujeres adultas, con indicación para infecciones asociadas con Escherichia coli, Proteus mirabilis y Staphylococcus saprophyticus. Ver FDA aprueba Pivya
La californiana Day One Biopharmaceuticals consiguió revisión prioritaria y luz verde para su oncológico Ojemda. Este inhibidor de RAF tipo 2 está indicado para pacientes a partir de los seis meses de edad con glioma pediátrico de bajo grado con fusiones o reordenamientos del gen BRAF, que es la alteración molecular más común en personas con este diagnóstico. El producto competirá con la combinación Tafinlar-Mekinist de la suiza Novartis, que recibió el aval de la FDA hace un año, pero que sólo está autorizado en casos con mutaciones BRAF V600, una versión menos frecuente. Ver FDA aprueba Ojemda
Pfizer recibió la aprobación para su terapia génica Beqvez para el tratamiento de adultos con hemofilia B de moderada a grave. Competirá con Hemgenix de CSL, que fue aprobado el año pasado para este raro trastorno hemorrágico que normalmente requiere infusiones regulares de una proteína que coagula la sangre. Ver FDA avala Beqvez de Pfizer, terapia génica
La FDA le dio su aval a Inceptiv, un dispositivo de estimulación de la médula espinal, de la irlandesa Medtronic. El producto permite ajustar la estimulación en tiempo real para el tratamiento del dolor crónico. Ver Medtronic: OK de la FDA
En tanto, el laboratorio X4 recibió su primer aval de la FDA y la primera aprobación de una terapia para el síndrome WHIM, verrugas, hipogammaglobulinemia, infecciones y mielotexis. El producto, Xolremdi, requirió una década de desarrollo. La firma estima que actualmente hay alrededor de 1.000 pacientes con WHIM en los EE.UU. pero cree que probablemente esté infradiagnosticada. Ver FDA: luz verde para Xolremdi de X4
Finalmente, el regulador estadounidense cerró el mes con la aprobación de Portrait VSM de GE Healthcare. El monitor portátil de signos vitales (VSM) que apunta a ayudar a los médicos a tomar decisiones de tratamiento y detectar el deterioro del paciente de forma temprana, mediante un flujo de trabajo de verificación optimizado con lecturas precisas de presión arterial, pulso, saturación de oxígeno, temperatura corporal y frecuencia respiratoria. Ver Press Release
En el campo de la Salud Animal, la estadounidense Elanco recibió el visto bueno para Pradalex, un antimicrobiano indicado para ciertas enfermedades respiratorias en ganado vacuno y porcino. El producto sólo puede ser recetado por un veterinario autorizado y la etiqueta incluye una declaración en la que consta que debe usarse sólo después de considerar otras opciones terapéuticas, ya que desde 1997 la FDA ha prohibido el uso fuera de la etiqueta de fluoroquinolonas en animales productores de alimentos. Ver FDA aprueba Pradalex