Después de un semestre que cerró con una larga lista de aprobaciones por parte de la FDA, el organismo arranca esta segunda parte del año con el aval para un producto para el HIV, que lleva el sello de ViiV Healthcare, propiedad de GSK, de Pfizer y de Shionogi.
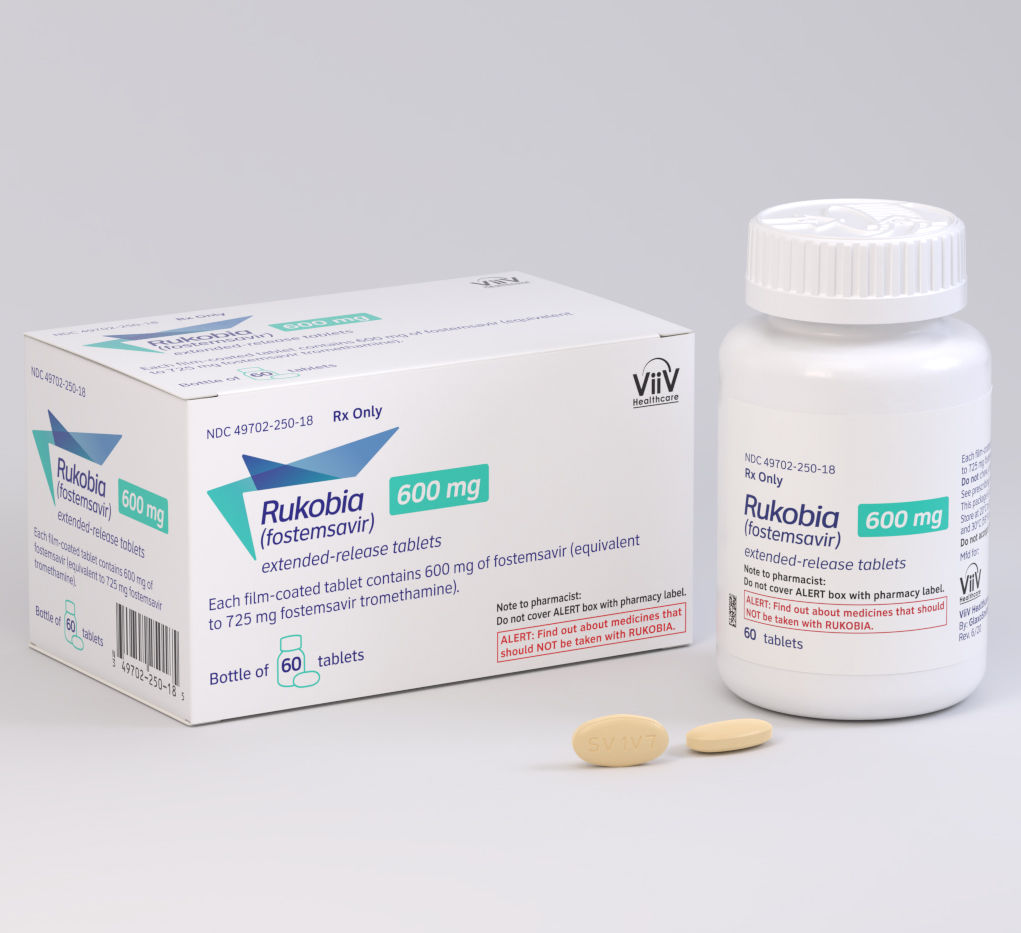
La FDA aprobó Rukobia, un nuevo tipo de antirretroviral para adultos con HIV que hubieran recibido múltiples tratamientos previos y cuya infección por HIV no se puede tratar con éxito con otras terapias debido a problemas de resistencia, u otras. Ver comunicado
De acuerdo a lo comunicado por el organismo estadounidense, previo a su autorización se evaluó la seguridad y eficacia del producto en un ensayo clínico de 371 personas, las que en su mayoría habían sido tratadas durante más de 15 años por HIV y que continuaron teniendo niveles altos del virus.
El medicamento a base de fostemsavir se administra dos veces al día por vía oral. El mismo recibió por parte de la FDA la designación Terapia Disruptiva y de Fast Track -vía rápida-. Además fue avalado bajo Revisión Prioritaria.
Rukobia lleva el sello de ViiV Healthcare, la firma británica enfocada en HIV que surgió a través de una alianza global entre Pfizer y GSK. En la Argentina la franquicia está bajo la división Biotech de GSK, la que combina la unidad de Vacunas y la de Enfermedades Raras. La misma quedó al mando de Pablo Galeazzi. Ver artículo.