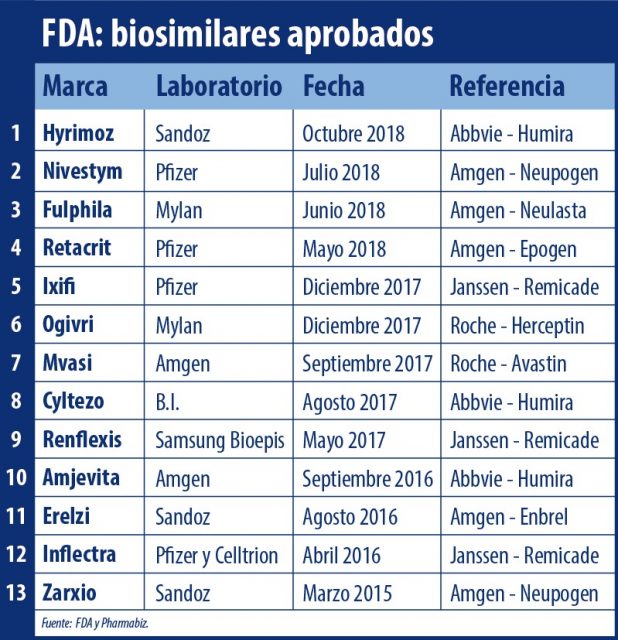
La FDA aprobó un nuevo biosimilar de la suiza Sandoz. Se trata de Hyrimoz, un bioequivalente de Humira de la norteamericana Abbvie. Así alcanzó un total de 13 biosimilares avalados.
La FDA le dio luz verde a un nuevo biosimilar que lleva el sello de la suiza Sandoz, el brazo de genéricos de Novartis.
Se trata de Hyrimoz un bioequivalente de Humira, de la norteamericana Abbvie. El mismo fue aprobado para siete indicaciones, entre ellas la de artritis reumatoidea, enfermedad de Crohn y psoriasis en placas. Ver información.
Hyrimoz se suma a otros dos biosimilares de Humira que ya habían obtenido el OK por parte de la agencia regulatoria. Son Cyltezo de la alemana Boehringer Ingelheim; y Amjevita de la norteamericana Amgen.
Así al día de hoy la FDA alcanza un total de 13 biosimilares avalados. Mientras que en Europa la EMA lleva la delantera con más de 40 aprobados.
Sin embargo, Hyrimoz estará disponible en los Estados Unidos recién en el 2023. Esto es en función de un acuerdo que sellaron Sandoz y Abbvie a principios de este mes luego de una disputa de patentes sobre el medicamento. En Europa, mientras tanto, el producto ya se comercializa desde este mes. Ver press release.