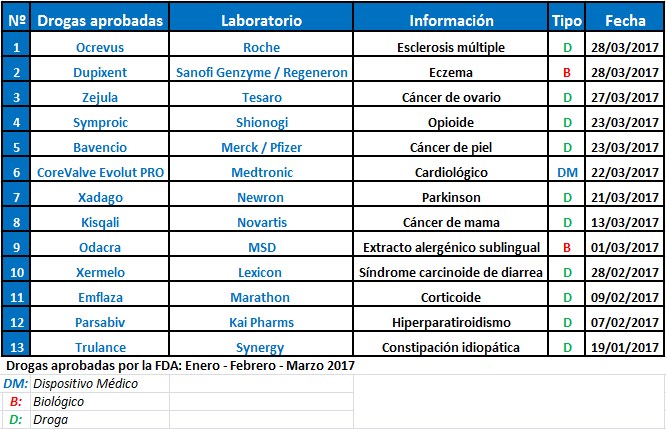
La FDA aprobó en el primer trimestre del año 12 nuevas moléculas. La punta la llevan los oncológicos. Se destacan Kisqali, de Novartis, y Bavencio, de Merck y Pfizer.
La FDA se mantiene súper activa aprobando nuevas moléculas. En el primer trimestre del año le levantó el pulgar a 13 nuevos productos: 10 tratamientos, dos biológicos y un device.
Entre las compañías que lograron el OK de la FDA se destacó la suiza Novartis con su oncológico Kisqali. El producto, que recibió la designación de terapia disruptiva, está indicado para el cáncer de mama metastásico. Ver artículo.
También consiguieron su aval la alemana Merck y la norteamericana Pfizer. Fue para Bavencio, un oncológico indicado para un tipo de cáncer de piel específico. Ver artículo.
La suiza Roche obtuvo el aval para Ocrevus, el primer y único tratamiento para las formas recurrentes y progresivas primarias de esclerosis múltiple.
Además la suiza Roche recibió la venia para Ocrevus, el primer y único tratamiento para las formas recurrentes y progresivas primarias de esclerosis múltiple. Ver artículo.
Otros productos
Otro oncológico que tuvo luz verde fue Zejula, del estadounidense Tesaro. Está indicado para el cáncer de ovario epitelial recurrente y fue calificado por el organismo regulatorio como medicamento huérfano. Ver artículo.
Asimismo, la FDA le levantó el pulgar al tratamiento complementario del Parkinson, Xadago, de la italiana Newron Pharmaceuticals. Ver artículo.
En cuanto a los biológicos, la norteamericana MSD recibió el visto bueno para Odactra, el primer extracto alergénico que se administra de forma sublingual. Por su parte, Sanofi y Regeneron obtuvieron luz verde para su tratamiento de eczema Dupixent.
El organismo de los Estados Unidos también le dio la venia a un combo de empresas de menor envergadura. Tal es el caso de la norteamericana Synergy Pharmaceuticals, que obtuvo el aval para Trulance, su fármaco para la constipación idiopática. Lo mismo ocurrió con el laboratorio Lexicon, que alcanzó el OK para Xermelo, un medicamento en comprimidos indicado para controlar el síndrome carcinoide de diarrea para personas con tumores carcinoides. Ver artículo. Ver artículo.
Además fue aceptado Emflaza, del norteamericano Marathon Pharmaceuticals, un corticoide para tratar la distrofia muscular de Duchenne (DMD). Y lograron el visto bueno Parsabiv, de Kai Pharms, indicado para hiperparatiroidismo secundario en pacientes adultos con riñón crónico (ERC) en hemodiálisis, y el opioide Symproic, del laboratorio japonés Shionogi. Ver artículo.
Biológicos
En cuanto a medicamentos biológicos, la norteamericana MSD recibió el OK para Odactra, el primer extracto alergénico que se administra de forma sublingual. Ver artículo.
Por su parte, Sanofi Genzyme y Regeneron obtuvieron luz verde para Dupixent, el único medicamento de esta categoría aprobado para casos de eczema, cuya enfermedad no se controla adecuadamente con terapias tópicas de prescripción, o cuando esas terapias no son aconsejables. Ver artículo.
En materia de tecnología médica, la FDA le levantó el pulgar a la irlandesa Medtronic para su cardiológico CoreValve Evolut PRO, una válvula autoexpansible para el tratamiento de la estenosis aórtica severa. Ver artículo.