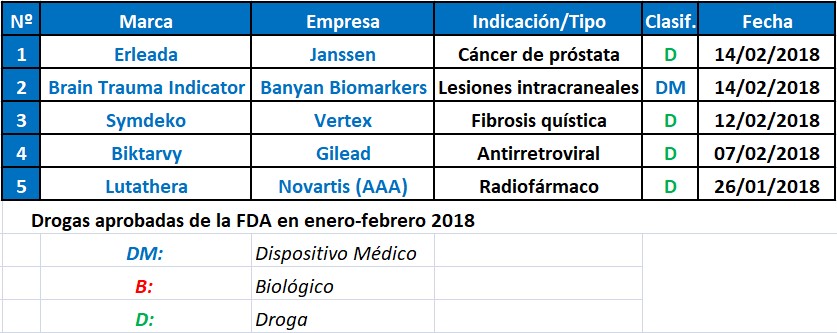
En el primer bimestre del año la FDA le levantó el pulgar a dos oncológicos. Por un lado Lutathera, de Novartis, un radiofármaco para un tipo de cáncer gastrointestinal. Por otro, Erleada, de Janssen, para cáncer de próstata no metastásico.
Pharmabiz realizó un relevamiento bimestral de las moléculas que aprobó la FDA durante los meses de enero y febrero.
Entre las compañías que obtuvieron el aval del organismo se destacó la suiza Novartis. La multi, que está adquiriendo a Advanced Accelerator Applications, recibió el visto bueno para Lutathera, un radiofármaco destinado a tratar cierto tipo de cáncer que afecta al páncreas o al tracto gastrointestinal, y por el que murió Steve Jobs, el fundador de Apple, en el 2011. Ver artículo.
Otro oncológico que consiguió el sí de la agencia regulatoria fue Erleada, de la norteamericana Janssen. Se trata del primer tratamiento avalado por la FDA para el cáncer de próstata no metastásico resistente a la castración. Es un tipo de cáncer en el que el tumor continúa creciendo aún cuando la cantidad de testosterona en el cuerpo se reduce a concentraciones muy bajas al realizar un tratamiento con terapia hormonal. Ver artículo.
El organismo también avaló a Biktarvy, un nuevo producto de la biotecnológica Gilead, indicado para tratar el HIV tipo 1. A su vez, le dio luz verde a Symdeko, de la norteamericana Vertex Pharmaceuticals, para fibrosis quística.
En paralelo, la FDA también le dio luz verde a Biktarvy, un nuevo producto para tratar el HIV tipo 1. El medicamento, que lleva el sello de la biotecnológica Gilead, combina en un comprimido de una sola toma diaria la droga bictegravir con Descovy, un medicamento a base de emtricitabine y tenofovir alafenamide. Ver artículo.
A su vez, el organismo aprobó Symdeko, de la norteamericana Vertex Pharmaceuticals. Se trata de un medicamento que combina las drogas tezacaftor e ivacaftor, y que está indicado para el tratamiento la fibrosis quística en personas mayores de 12 años y que tienen una mutación en un gen específico. Ver aprobación.
En materia de medical devices, la agencia regulatoria avaló a Brain Trauma Indicator, el primer test sanguíneo para evaluar lesiones cerebrales traumáticas leves en adultos, comúnmente conocidas como conmociones cerebrales. El producto lleva el sello de Banyan Biomakers. Ver aprobación.