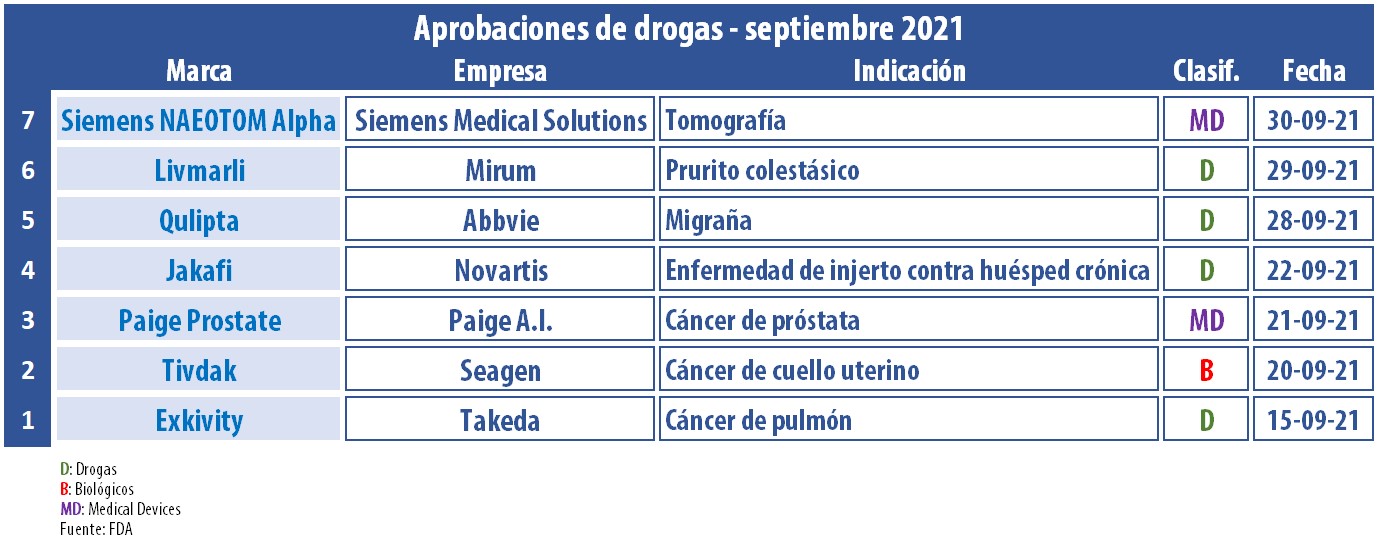
El segmento de Onco sigue siendo la estrella de Farma. En este septiembre, se constituyó como protagonista de la agenda de aprobaciones de la FDA. De los siete productos que recibieron el visto bueno de la agencia, tres se enrolaron en esta categoría.
La FDA no detiene su ritmo de aprobaciones extra COVID-19. En el mes de septiembre la agencia norteamericana otorgó una variada gama de avales. El primero en recibir el visto bueno fue Exkivity, de la japonesa Takeda, un producto a base de mobocertinib para el tratamiento de adultos con cáncer de pulmón de células no pequeñas, localmente avanzado o metastásico, con ciertas mutaciones genéticas. En simultáneo también le dio el OK a un test de Thermo Fisher para identificar a las personas que pueden recibir la terapia. Ver «FDA aprobó Exkivity a Takeda».
Otro que obtuvo luz verde en este período fue el biológico Tivdak, el que lleva el sello de la norteamericana Seagen. Este anticuerpo, a base de tisotumab vedotin-tftv, está dirigido a mujeres con cáncer de cuello uterino recurrente o metastásico con progresión de la enfermedad, durante o después de una quimioterapia. El inyectable fue avalado mediante revisión prioritaria. Ver Press Release FDA. / Ver Press Release Seagen.
El segmento de la migraña sigue sumando players. Este mes la que consiguió un OK fue la norteamericana Abbvie para su producto Qulipta. El mismo está indicado para el tratamiento preventivo de la migraña episódica en adultos y se suma a una categoría híper competitiva en la que pisan fuerte Eli Lilly, Amgen, Novartis y Teva. Ver «FDA aprueba Qulipta, Abbvie».
Por otra parte, Livmarli se integró a la lista de medicamentos aprobados por la FDA en septiembre. Este tratamiento contra el prurito colestásico en personas con síndrome de Alagille fue desarrollado por Mirum Pharma, y está indicado a partir del primer año de vida. Según el laboratorio, Livmarli es la primera terapia avalada para esta enfermedad hepática rara. Ver Press Release Mirum Pharma.
En el campo de los devices también hubo novedades. Paige Prostate se constituyó en el primer software basado en inteligencia artificial y diseñado para identificar un área de interés en la imagen de las biopsias de próstata. La FDA aprobó el dispositivo de la estadounidense Paige I.A. a través del programa De Novo de revisión previa a la comercialización, una vía reguladora para dispositivos de riesgo bajo a moderado de un nuevo tipo. Ver Press Release FDA.
Otro device que recibió el visto bueno de la FDA en este septiembre es Siemens NAEOTOM Alpha, desarrollado por la alemana Siemens Medical Solutions. De acuerdo con la agencia, se trata de la primera gran mejora tecnológica para la obtención de imágenes por tomografía computarizada (TC) en casi una década. El dispositivo cuenta con detectores de conteo de fotones, los que pueden medir cada rayo X individual, a diferencia de los sistemas actuales que usan detectores que miden la energía total contenida en muchos rayos X a la vez. Ver Press Release FDA.
Al listado de autorizaciones del mes se sumó también Jakafi. El producto, que es comercializado para la mielofibrosis desde el 2009 por Novartis en la Argentina y en otros países, y por Incyte en Estados Unidos, fue respaldado con una nueva indicación. La FDA le levantó el pulgar para la enfermedad de injerto contra huésped crónica (cGVHD), después del fracaso de una o dos líneas de terapia sistémica. Ver Press Release FDA.