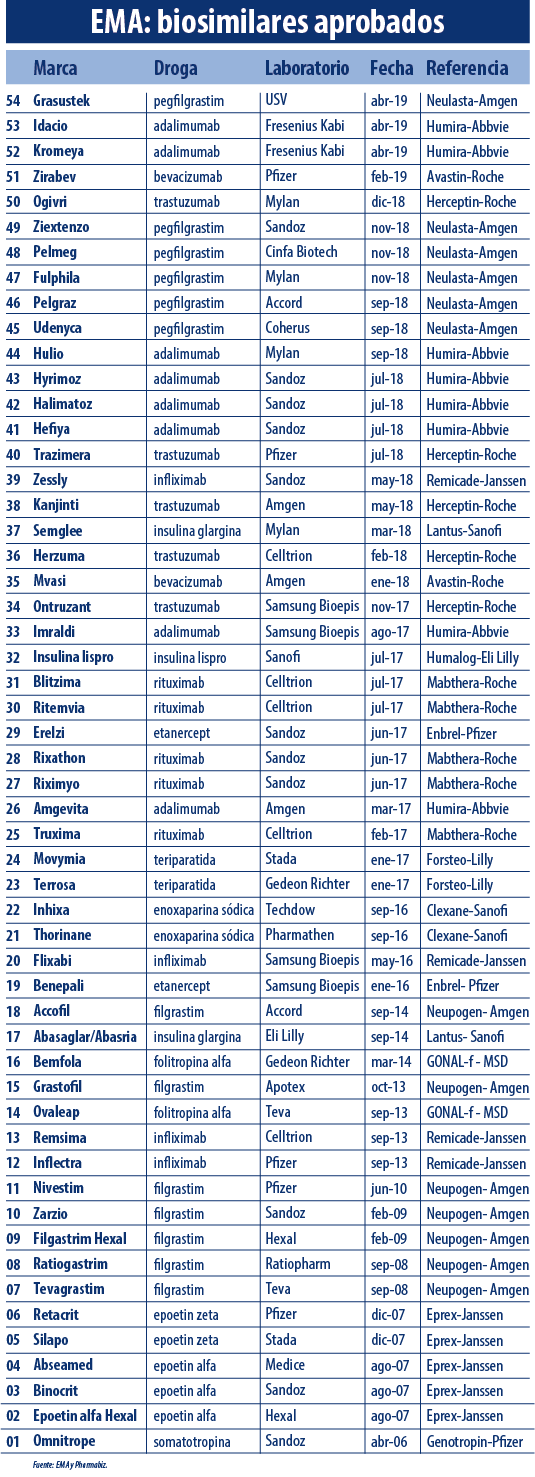
La EMA ya supera el medio centenar de biosimilares aprobados. El primer semestre cerró con el aval de Grasustek, de la firma india USV, el que toma como referencia a Neulasta el bio de Amgen que tiene seis copias avaladas por el organismo.
La agencia regulatoria de Europa, la EMA, sigue a la delantera en materia de biosimilares aprobados. A pesar de que no estuvo muy activa en estos últimos dos meses, continúa por encima de su par norteamericana, la FDA.
De acuerdo al análisis realizado por el equipo de Pharmabiz, al momento el organismo europero le levantó el pulgar a 54 productos enrolados bajo esta categoría. Así, mantiene el mismo número de avales que este medio reportó en mayo, aunque con algunas modificaciones en la tabla. Ver artículo.
Por caso le dio la baja a Ruxience, un medicamento que lleva el sello de Pfizer y que toma como referencia a Mabthera, el oncológico de Roche. El mismo está indicado para linfoma no Hodgkin.
Sin embargo la cifra final se cerró con la autorización de Grasustek de la firma india USV. El producto es un bioequivalente de Neulasta de Amgen, el que ya suma seis copias avaladas por la EMA.
Así, mientras la agencia regulatoria de Europa ya supera el medio centenar de biosimilares, la FDA totaliza casi la mitad, con 23 productos de este tipo. El último al que le dio el OK fue justamente Ruxience, el que fue desaprobado por la EMA. Ver Artículo.