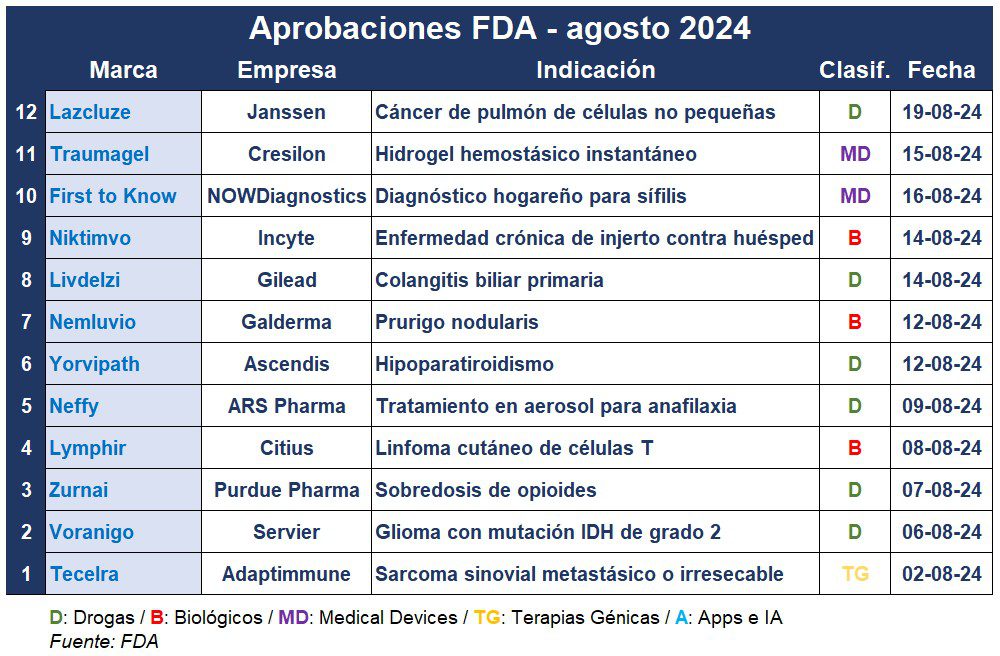
La FDA cerró agosto con más de una docena de nuevas aprobaciones. Entre estas se encuentra un hidrogel que detiene hemorragias en el acto, un tratamiento de emergencia para alergias graves que se aplica con spray, y un test de sífilis para el hogar.
Este agosto, la francesa Servier recibió el visto bueno para Voranigo, la primera terapia aprobada por la FDA para un tipo de tumor cerebral que hasta ahora solo se trataba con su extirpación. Este es un producto que la multi obtuvo a través de su adquisición del negocio de oncología de Agios Pharma por u$s 2.000 M en 2021. Ver nota Voranigo
La FDA le concedió a la norteamericana Janssen la aprobación de Lazcluze por vía prioritaria, para su utilización en conjunto con su producto Rybrevant. Esta combinación se constituye en el primer y único régimen sin quimioterapia para el cáncer de pulmón de células no pequeñas, que muestra una supervivencia sin progresión superior a la de osimertinib. Ver Press Release
La suiza Galderma recibió el aval de la FDA para Nemluvio, indicado para prurigo nodularis, una enfermedad de la piel debilitante y con picazón. A base de nemolizumab, el anticuerpo monoclonal de primera clase viene en un inyector precargado para su aplicación subcutánea mensual. La multi accedió a Nemluvio por un acuerdo de licencia con Chugai Pharmaceutical, filial de Roche, en 2016. Ver nota Nemluvio
En agosto, la biotecnológica Adaptimmune consiguió la aprobación acelerada de la FDA para Tecelra, su tratamiento para el sarcoma sinovial metastásico o irresecable. Tecelra es la primera terapia celular diseñada para un tumor sólido, la primera terapia TCR-T que ingresa al mercado y el primer tratamiento nuevo con esta indicación en más de una década. Ver nota Tecelra
La FDA le subió el pulgar a Zurnai, de la norteamericana Purdue Pharma, como el primer autoinyector de clorhidrato de nalmefeno, diseñado para el tratamiento de emergencia de la sobredosis de opioides sospechada o conocida en adultos y pacientes pediátricos de 12 años o más. Viene precargado con una dosis única y se administra por vía subcutánea o intramuscular. Ver nota Zurnai
Otra que recibió el aval de la FDA en agosto fue Lymphir de la estadounidense Citius Pharmaceuticals. El producto es una inmunoterapia dirigida para una indicación inicial en el tratamiento del linfoma cutáneo de células T. Es la primera aprobación para la empresa de New Jersey, y se espera que llegue al mercado en los próximos cinco meses. Ver Press Release
Neffy, de la empresa de California ARS Pharmaceuticals, recibió la aprobación de la FDA. Es el primer tratamiento de emergencia sin agujas para reacciones alérgicas potencialmente fatales, que se presenta como una alternativa a los autoinyectores de epinefrina como EpiPen de Meridian y Mylan. Neffy es un aerosol de dosis única que se administra en una fosa nasal, y está aprobado para adultos y menores que pesen al menos 30 kilogramos. Ver nota Neffy
En agosto también, la FDA le dio luz verde a Yorvipath de la danesa Ascendis Pharma, que se convierte en el primer tratamiento para el hipoparatiroidismo, una enfermedad endocrina poco común causada por niveles insuficientes de hormona paratiroidea (PTH) que afecta múltiples órganos. Yorvipath se administra una vez al día, ya que está diseñado para proporcionar una exposición continua a la PTH liberada durante un período de dosificación de 24 horas. Ver Press Release
La FDA concedió la aprobación acelerada a Livdelzi, de la estadounidense Gilead. Es un tratamiento para la colangitis biliar primaria, una enfermedad hepática que provoca la inflamación de los pequeños conductos biliares en el hígado y puede destruirlos. Gilead adquirió el producto mediante su compra de CymaBay Therapeutics por u$s 4.300 millones a principios de este año. Ver nota Livdelzi
La norteamericana Incyte obtuvo el visto bueno de la FDA para Niktimvo este agosto. Así se convierte en el primer anticuerpo anti-CSF-1R aprobado que se dirige a los impulsores de la inflamación y la fibrosis que se observan en la enfermedad de injerto contra huésped (EICH) crónica. Esta afección puede ocurrir después de un trasplante alogénico de células madre, en el que las células donadas inician una respuesta inmunitaria y atacan los órganos del receptor. Ver Press Release
First To Know Syphilis, de la estadounidense NOWDiagnostics, se conviritó este mes en la primera prueba hogareña de venta libre que detecta anticuerpos contra Treponema pallidum (sífilis) en sangre humana. La prueba proporciona un resultado en casa sin receta en aproximadamente 15 minutos. Ver nota First to Know
También en agosto, la norteamericana Cresilon recibió el aval de la FDA para su hidrogel hemostásico. Traumagel combina compuestos de algas y hongos para tratar rápidamente la pérdida de sangre de moderada a grave por heridas de bala o hemorragias relacionadas con lesiones. El producto viene precargado en una jeringa y no requiere preparaciones complejas, lo que permite aplicaciones rápidas en comparación con las gasas y torniquetes tradicionales. Ver nota Traumagel
El último viernes de agosto, la FDA autorizó la comercialización del sistema Minima Stent de Renata Medical para el tratamiento de la estenosis de la arteria pulmonar y coartación aórtica, dos formas congénitas de estrechamiento de las arterias, en recién nacidos, bebés y niños de al menos 1,5 kg de peso. El stent está diseñado para expandirse periódicamente en pos de mantenerse al día con el crecimiento de los vasos, a la vez que ofrece una opción menos invasiva que la cirugía cardíaca.
Por otro lado, el regulador le dio su aval a Chronos, de Germitec, como una alternativa libre de químicos para la desinfección de superficies de sondas de ultrasonido transvaginales, transrectales y externas que no contienen conductos internos ni hendiduras o canales que sean más profundos que anchos. Se colocan las sondas limpias dentro de la cámara, donde se exponen a la radiación UV para su desinfección. Ver Press Release.