La FDA cerró junio con más de una docena de nuevas aprobaciones. La lista del mes incluye una vacuna conjugada 21-valente contra el neumococo, un tratamiento para un grupo de trastornos de la médula ósea, dos nuevos dispositivos de control de la glucosa, y la aprobación acelerada de una molécula para la colangitis biliar primaria. La biotech californiana Geron recibió el aval de la FDA para Rytelo, diseñado para tratar un grupo de trastornos de la médula ósea llamados síndromes mielodisplásicos (SMD). A base de imetelstat, el inhibidor de la telomerasa está indicado para adultos con SMD de riesgo bajo a intermedio y anemia dependiente de transfusiones que no han respondido, han perdido respuesta o no son elegibles para recibir agentes estimulantes de la eritropoyesis. La empresa fijó el costo de adquisición mayorista de un vial monodosis de 47 mg en u$s 2.471. Las dosis están determinadas por el peso corporal del paciente. Ver FDA aprueba Rytelo La agencia regulatoria aprobó dos nuevos dispositivos de control de la glucosa de la norteamericana Abbott, ambos de venta libre. Uno de estos, Libre Rio, está dirigido a personas con diabetes tipo 2 que no usan insulina y generalmente controlan su diabetes mediante modificaciones en el estilo de vida. El otro producto, Lingo, ayudará a realizar un seguimiento de la glucosa y proporcionará información personalizada en pos de mejorar el bienestar general de personas sin diabetes que están preocupadas por su salud. Ambos están basados en su tecnología FreeStyle Libre. Ver FDA aprueba Lingo y Libre Rio Los franceses Ipsen y Genfit consiguieron una aprobación acelerada para Iqirvo. El producto está indicado para la colangitis biliar primaria o CBP, y funciona activando ciertos receptores, que reducen la inflamación, aumenta el transporte de ácidos biliares fuera del hígado y promueve su desintoxicación. Su precio está estimado en u$s 11.500 por un suministro mensual, y competirá con Ocaliva de Intercept Pharmaceuticals. Ver FDA aprueba Iqirvo La FDA también anunció que amplió el rango etario recomendado para utilizar Arexvy, la primera vacuna contra el virus sincicial respiratorio (VSR) avalada en el mundo, desarrollada por la británica GSK. Aprobada en mayo del 2023 para adultos mayores de 60 años, ahora personas a partir de los 50 también podrán utilizarla. Esta actualización llega un mes después de que la estadounidense Moderna logre la aprobación de su propia vacuna contra el VSR: mRESVIA. Ver FDA aprueba Arexvy 2023 | Ver actualización FDA La FDA aprobó Capvaxive, de la estadounidense MSD. Esta es una vacuna conjugada 21-valente para proteger contra el neumococo en pacientes adultos. Hay alrededor de 100 cepas de bacterias que pueden causar la enfermedad. En un ensayo, la vacuna de MSD ayudó a producir una respuesta inmune contra 21 serotipos de la bacteria. En el mercado competirá con Prevnar 20 de Pfizer. Ver FDA aprueba Capvaxive La norteamericana Pyros Pharmaceuticals recibió la aprobación de la FDA para Vigafyde, una monoterapia para pacientes pediátricos de entre un mes y dos años de edad con espasmos infantiles (EI). Esta es la primera solución oral de vigabatrina en recibir aprobación, y está indicada siempre y cuando los beneficios potenciales justifiquen el riesgo de pérdida de visión. Según la empresa, estará disponible en los Estados Unidos en la segunda mitad de 2024. Ver FDA aprueba Vigafyde La agencia regulatoria le dio luz verde a un videojuego como la primera terapia digital de venta libre para adultos con trastorno por déficit de atención e hiperactividad. Se trata de EndeavorOTC de la empresa de terapias digitales Akili, que obtiene así su segunda autorización. La compañía advirtió que el juego debe usarse como parte de un programa terapéutico, el que también podría incluir terapia dirigida por un médico, medicación y/o programas educativos. Ver FDA aprueba EndeavorOTC Por el ala veterinaria, ZyVet Animal Health obtuvo el visto bueno para los primeros comprimidos masticables genéricos de clorhidrato de fenilpropanolamina para el control de la incontinencia urinaria debido al hipotonía del esfínter uretral en perros. El producto contiene el mismo ingrediente activo en la misma concentración y forma de dosificación que las tabletas masticables Proin de PRN Pharmacal. Ver FDA aprueba genéricos Proin La especialista estadounidense en dermatología Botanix Pharmaceuticals consiguió la aprobación de la FDA para Sofdra. Este gel tópico a base de sofpironium se convierte en el primer producto químico para el tratamiento de la hiperhidrosis axilar primaria (sudoración excesiva de las axilas), y está indicado para mayores de 9 años. La compañía planea lanzar un programa de experiencia temprana en el tercer trimestre del año 2024. Ver Press Release La suiza Roche recibió luz verde para Piasky, su tratamiento de la hemoglobinuria paroxística nocturna (HPN), en personas mayores de 13 años. La HPN es una afección sanguínea rara y potencialmente mortal en la que parte del sistema inmune del cuerpo destruye los glóbulos rojos. Puede provocar síntomas como anemia, fatiga y coágulos de sangre. Piasky contiene crovalimab-akkz, un inhibidor de C5 que se recicla en el torrente sanguíneo. Se administra como una dosis de carga única mediante infusión intravenosa, seguida de cuatro dosis de carga semanales. Ohtuvayre se convirtió en la primera terapia aprobada para el laboratorio británico Verona Pharma. A base de ensifentrine, el producto inhalado recibió el aval de la FDA para tratar la enfermedad pulmonar obstructiva crónica (EPOC). La terapia relaja los músculos alrededor de las vías respiratorias, facilitando la respiración y reduciendo la inflamación en los pulmones sin usar esteroides. Ver FDA aprueba Ohtuvayre Cepheid, una empresa estadounidense que se especializa en diagnósticos, consiguió el OK de la FDA para su prueba Xpert HCV Test y el sistema GeneXpert Xpress para el virus de la hepatitis C (VHC). El producto se convierte en el primer diagnóstico ARN de VHC que se puede utilizar directamente en entornos de atención certificados para individuos en riesgo. La prueba detecta el ARN del VHC y entrega resultados en aproximadamente una hora utilizando una muestra de sangre de la yema del dedo. Ver FDA: OK para test VHC de Cepheid La FDA le dio luz verde a Tepylute, de la norteamericana Shorla Oncology, para tratar el adenocarcinoma de mama y ovario. El producto es una formulación líquida lista para diluir del agente de tratamiento standard tiotepa. La nueva formulación elimina la necesidad de una reconstitución compleja que requiere mucho tiempo y permite una precisión constante en la dosificación. Ver FDA: luz verde para Tepylute de Shorla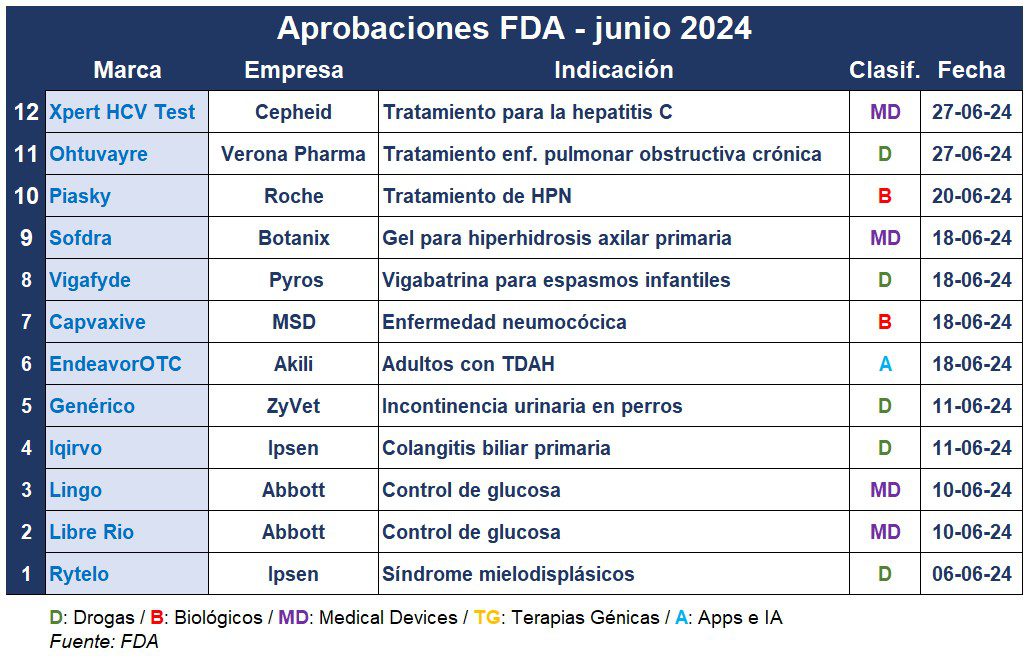

Las aprobaciones FDA de junio















