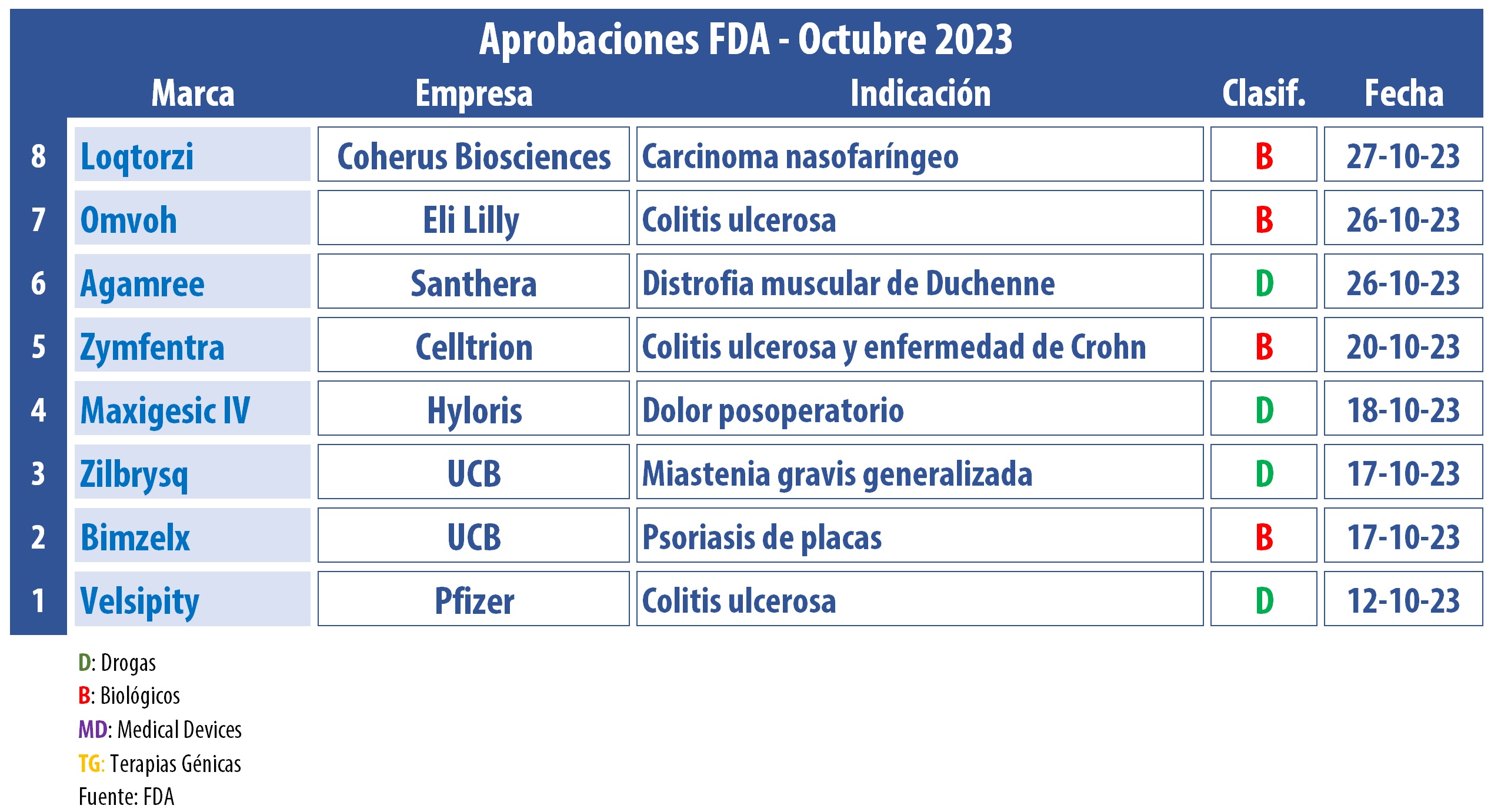
La FDA cerró el décimo mes del año con una variedad de nuevas aprobaciones. La lista incluye un nuevo tratamiento para la colitis ulcerosa, una infusión para el dolor posoperatorio sin opioides, y dos nuevos productos de la belga UCB.
La norteamericana Pfizer consiguió el visto bueno de la FDA para Velsipity, su nuevo modulador de receptores S1P para adultos con colitis ulcerosa de moderada a grave. Se trata de un tratamiento oral a base de etrasimod que se toma una vez al día, y que llega para competir con Zeposia de la estadounidense BMS, en el mercado desde el 2021. Ver nota Velsipity
La agencia regulatoria aprobó Maxigesic IV, de la belga Hyloris Pharmaceuticals. El producto es una combinación de paracetamol con una solución de ibuprofeno para la infusión. Se espera que ayude a reducir el dolor y la inflamación en cuadros posoperatorios en hospitales o cuando los pacientes no pueden tomar medicamentos por vía oral, sin el riesgo de la adicción a los opioides. Ver Press Release
La FDA generó dos noticias positivas en octubre para el laboratorio belga UCB. Por un lado, le dio el visto bueno a Zilbrysq, para tratar la miastenia gravis generalizada o MGG en adultos con anticuerpos positivos contra el receptor de acetilcolina (AChR)1. El producto es el primer inhibidor del complemento C5 dirigido por vía subcutánea una vez al día para esta enfermedad, y la única de una vez al día para autoadministración. Asimismo, la empresa recibió el aval para Bimzelx, a base de bimekizumab, una terapia para la psoriasis de placas de moderada a grave. Ver nota UCB
El regulador estadounidense aprobó Zymfentra de Celltrion, la primera formulación subcutánea a base de infliximab-dyyb autorizada para uso como terapia de mantenimiento para adultos con colitis ulcerosa activa de moderada a grave, y para la enfermedad de Crohn. El producto es una versión subcutánea de Inflectra de Celltrion, un biosimilar que toma de referencia a Remicade. Su ventaja es que se autoadministra en el hogar en lugar de administrarse como una infusión en un consultorio o clínica. Ver Press Release
Otra que recibió una luz verde fue la suiza Santhera. A base de vamorolone, su desarrollo Agamree está indicado para el tratamiento de la distrofia muscular de Duchenne. Agamree funciona de manera similar a los corticosteroides como la prednisona, sin embargo no presenta los mismos problemas, como el aumento excesivo de peso y el crecimiento del cabello. En Norteamérica, el laboratorio suizo concedió los derechos comerciales para la fabricación y distribución a Catalyst Pharmaceuticals. Ver nota Agamree
En la última semana de octubre, la FDA autorizó Omvoh, el producto de la estadounidense Eli Lilly para el tratamiento de la colitis ulcerosa. Fue aprobado para tratar a adultos en casos moderados y graves. El regulador lo había rechazado en abril citando problemas relacionados con la fabricación. A base de mirikizumab, el producto bloquea la proteína interleucina-23 (IL-23) que participa en esta enfermedad inflamatoria intestinal crónica. Ver nota Omvoh
La FDA también aprobó Loqtorzi, de Coherus BioSciences bajo licencia del laboratorio chino Junshi. El producto a base de toripalimab-tpzi fue avalado en combinación con cisplatino y gemcitabina para el tratamiento de primera línea de adultos con carcinoma nasofaríngeo (NPC) localmente avanzado metastásico o recurrente y como agente único para adultos con NPC recurrente irresecable o metastásico con progresión de la enfermedad durante o después de una quimioterapia que contiene platino. Ahora es la primera terapia aprobada por la FDA para NPC y el primer producto innovador chino de anticuerpos en el mercado estadounidense. Ver nota Loqtorzi