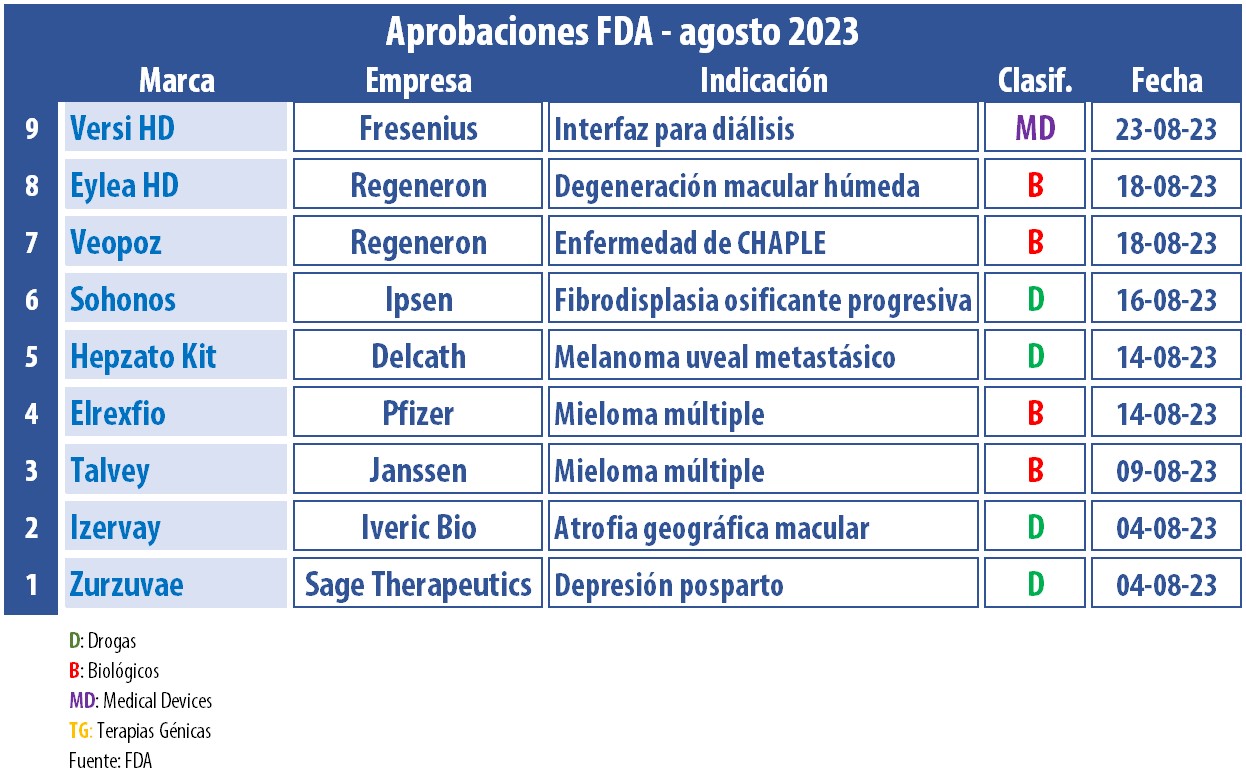
El octavo mes del año trajo consigo múltiples aprobaciones de la FDA. La lista cuenta con desarrollos indicados para un amplio espectro de patologías, desde cánceres raros hasta depresión posparto.
La FDA le concedió la aprobación acelerada a Elrexfio. Se trata de un anticuerpo biespecífico de la norteamericana Pfizer, para el tratamiento del mieloma múltiple, un tipo de cáncer de sangre, en personas que ya transitaron al menos cuatro líneas de terapias previas. Ver artículo Elrexfio.
Otro anticuerpo biespecífico al que la FDA le subió el pulgar es a Talvey, de la norteamericana Janssen. Al igual que Elrexfio, este inyectable está indicado para adultos con mieloma múltiple, también en aquellos casos en que se ya haya atravesado otros tratamientos previos, incluido un inhibidor del proteasoma, un agente inmunomodulador y un anticuerpo anti-CD38. Ver Press Release FDA / Ver Press Release Janssen.
A su vez, el regulador le dio luz verde a Zurzuvae, el que lleva el sello de la norteamericana Sage Therapeutics. Este es el primer medicamento oral avalado para la depresión posparto, el que debe ser administrado de forma diaria y durante 14 días. Ver artículo Zurzuvae.
Otro que recibió el visto bueno fue Izervay, de la norteamericana Iveric Bio, una subsidiaria de Astellas. Izervay es un inhibidor del complemento C5. Según se precisó, esta solución intravítrea reduce la progresión de la atrofia geográfica en la retina del ojo, producto de la progresión del diagnóstico de degeneración macular seca relacionada con la edad. Ver Press Release Izervay.
A lo largo de este mes, la FDA respaldó a su vez el primer tratamiento para la enteropatía con pérdida de proteínas por deficiencia de CD55, conocida como la enfermedad de CHAPLE. Se trata de Veopoz, un biológico a base de pozelimab, que lleva el sello de la estadounidense Regeneron. Ver artículo Veopoz.
Regeneron también consiguió luz verde para su inyectable Eylea HD. Este es un tratamiento mensual para personas con pérdida rápida de visión relacionada a diagnósticos de degeneración macular húmeda, edema macular diabético, o retinopatía diabética. Ver Press Release Regeneron.
A su vez, el regulador estadounidense aprobó un producto del francés Ipsen. Se trata de Sohonos, el que fue indicado para fibrodisplasia osificante progresiva, un trastorno genético del tejido conectivo que causa un crecimiento óseo anormal, una pérdida progresiva de movilidad y una reducción en la esperanza de vida. Sohonos fue catalogado como el primer tratamiento para esta afección. Ver artículo Sohonos.
Durante agosto, la FDA también le dio el OK a la estadounidense Delcath, para Hepzato Kit. Se trata de un inyectable a base de melfalán, el que se administra a través del componente del dispositivo, el sistema de administración hepática. El mismo está indicado para adultos con melanoma uveal metastásico con metástasis hepáticas irresecables. Ver artículo Hepzato Kit.
Desde el wing de los devices, los alemanes de Fresenius recibieron el visto bueno para Versi HD. Se trata de un nuevo software con tecnología Self-Guide, para el uso en dispositivos de diálisis domiciliarias. De acuerdo con la firma, el mismo permite mejorar la interfaz de estos devices y facilita así la transición del hospital al hogar, a la vez que mejora la experiencia de pacientes y cuidadores. Ver Press Release Fresenius.
Finalmente, el 30 de agosto, la canadiense AION anunció que recibió el aval de la FDA para su dispositivo y sistema de software iTempShield para uso en adultos y niños desde los cinco años en hospitales y centros de atención y para la venta sin receta a consumidores. Se trata de un dispositivo del tamaño de una moneda que se puede llevar sobre la piel del pecho para permitir la medición continua de la temperatura corporal para usos como el control de sepsis oncológica, la detección de infecciones posquirúrgicas, cuidados a largo plazo y de la salud en el hogar. Se conecta a software basado en la nube. Ver Press Release.