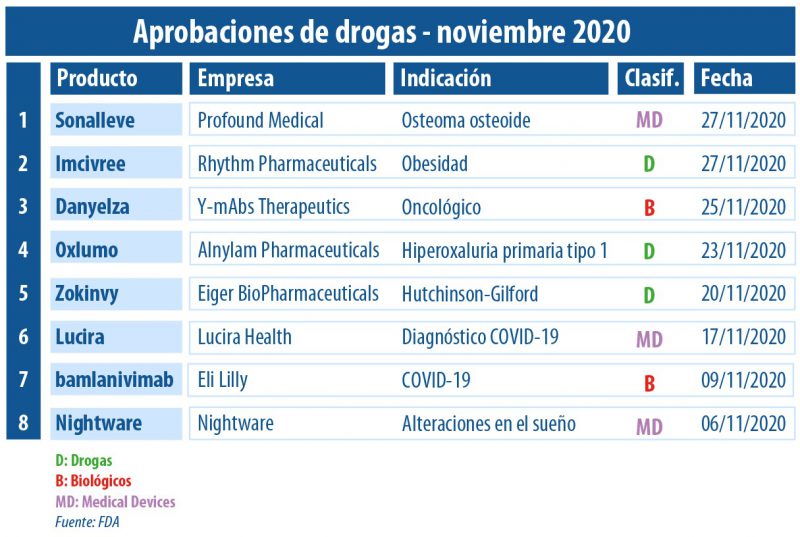
La agencia regulatoria norteamericana pisó el acelerador en materia de coronavirus. Entre las venias de noviembre, se destacaron la autorización del uso de emergencia de un anticuerpo neutralizado para el COVID-19 de la norteamericana Eli Lilly, y el aval al primer test de uso hogareño para detectar la enfermedad.
A poco de cerrar este 2020 atípico, Pharmabiz realizó un informe sobre los principales productos aprobados por la FDA a lo largo de noviembre.
Las enfermedades raras siguen anotando novedades. Por caso, en este período obtuvo luz verde el primer tratamiento para el síndrome de Hutchinson-Gilford y algunas laminopatías progeroides. Se trata de Zokinvy de la norteamericana Eiger BioPharmaceuticals, el que recibió la designación de droga huérfana y de terapia disruptiva. Ver artículo.
En la misma línea de trastornos genéticos raros, la FDA le otorgó el OK a Oxlumo, de Alnylam. Es un producto que fue desarrollado para la hiperoxaluria primaria tipo 1 (PH1), una condición poco común que causa cálculos renales recurrentes y pérdida de la función renal.
Y, en sintonía, logró la venia Imcivree, el primer tratamiento para el control crónico del peso en casos de obesidad asociada a tres afecciones genéticas raras. La terapia, a base de setmelanotida, es la primera de la norteamericana Rhythm Pharmaceutical que obtiene el visto bueno para salir al mercado. Ver artículo.
Además en este noviembre, la agencia regulatoria le dio luz verde al biológico Danyelza de la norteamericana Y-mAbs Therapeutics. Este oncológico apunta a personas desde un año de edad con neuroblastoma de alto riesgo recidivante o refractario, en el hueso o la médula ósea. Ver Press Release.
En esta era de pandemia, fue autorizado el uso de emergencia de un nuevo medicamento de la norteamericana Eli Lilly. Se trata de un anticuerpo neutralizado a base de bamlanivimab que aún está en etapa clínica. El mismo está indicado para el tratamiento del COVID-19 de leve a moderado en adultos y niños a partir de los 12 años, que tengan alto riesgo de empeorar o requerir hospitalización. Ver artículo.
Y en sintonía, la FDA le levantó el pulgar a Lucira COVID-19 All-In-One Test Kit, el primer test de uso hogareño para detectar el coronavirus. El device se constituye como una prueba de auto-diagnóstico y de tipo molecular. Esta novedad, que lleva el sello de la norteamericana Lucira Health, fue respaldado para personas a partir de los 14 años que se sospeche tengan coronavirus. Ver artículo.
En materia de dispositivos médicos el organismo regulatorio le dio el sí a otro producto: Nightware, el que lleva la firma de la empresa homónima norteamericana. El mismo funciona a base de vibraciones y apunta a la reducción de las alteraciones en el sueño en adultos con trastorno de pesadilla o de estrés postraumático (TEPT). La FDA le concedió la designación de dispositivo innovador, y detalló que no es una terapia independiente, sino que se debe usar en combinación con los medicamentos recetados. Ver artículo.
Y otro que se llevó el OK fue el device Sonalleve MR-HIFU system, que pertenece a Profound Medical y que está indicado para el tratamiento del osteoma osteoide en las extremidades. Se trata de un producto basado en una técnica guiada por imágenes que combina el ultrasonido de alta intensidad con monitoreo en tiempo real. Ver press release.