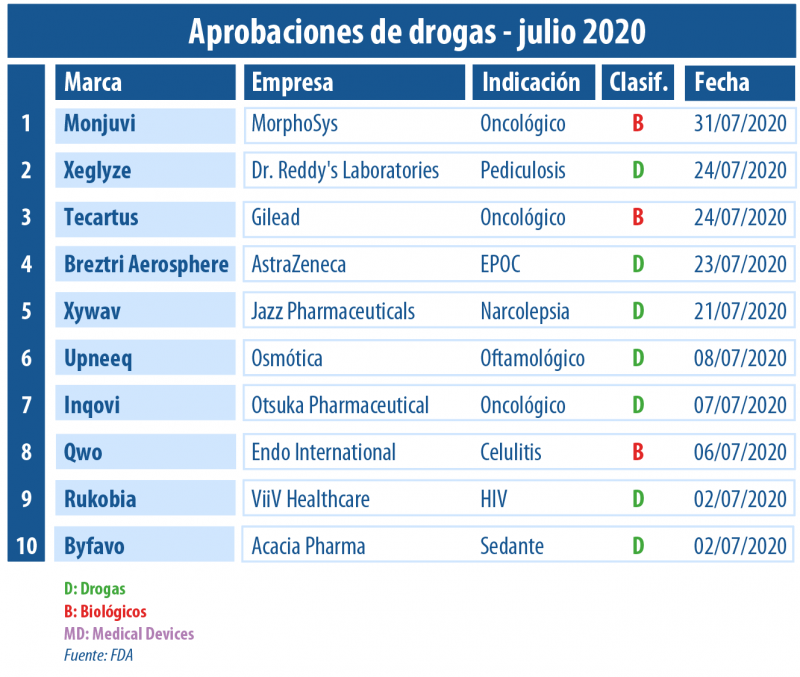
Una gran variedad de novedades recibió el aval de la FDA a lo largo de este julio de cuarentena. Por caso, se destacó la venia que obtuvo la compañía de origen argentino Osmótica para su solución oftálmica Upneeq.
Más allá de la pandemia del COVID-19, la agencia regulatoria norteamericana siguió respaldando con su sello a diversos productos. Fueron diez las principales aprobaciones otorgadas en este séptimo mes del año.
Por caso, la FDA le dio luz verde a Rukobia, de ViiV Healthcare, la firma propiedad de GSK, de Pfizer y de Shionogi. Es un nuevo tipo de antirretroviral para adultos con HIV que hubieran recibido múltiples tratamientos previos y cuya infección no responde a otras terapias debido a problemas de resistencia, u otros. Ver artículo.
Asimismo, una novedad que obtuvo el visto bueno fue la desarrollada por la compañía de origen argentino Osmótica, experta en formulaciones de liberación prolongada. El aval fue para la solución oftálmica Upneeq, indicada para la blefaroptosis adquirida o ptosis, o la caída anormal del párpado superior que puede limitar el campo de visión. Ver Press Release.
En tanto, tres oncológicos fueron aprobados. Uno de ellos fue el biológico Tecartus de la norteamericana Gilead. Se constituyó como la primera terapia génica basada en células en recibir luz verde del organismo para el linfoma de células del manto. También consiguieron el OK Inqovi, de Otsuka Pharmaceuticals, para un tipo de leucemia; y Monjuvi de la alemana MorphoSys para un linfoma no Hodgkin.
En tanto, uno de los oncológicos aprobados en este período fue Inqovi del laboratorio con sede en California Astex Pharmaceuticals, una subsidiaria de la japonesa Otsuka Pharmaceutical. El medicamento está dirigido a adultos con síndrome mielodisplásico y leucemia mielomonocítica crónica. Ver artículo.
El segundo producto para el cáncer que consiguió el OK fue el biológico Tecartus de Kite Pharma, una farmacéutica que la biotecnológica norteamericana Gilead adquirió en el 2017. Es la primera terapia génica basada en células en tener luz verde para el linfoma de células del manto en adultos que no hayan respondido a tratamientos previos. Ver artículo.
Para completar la tríada, obtuvo el sí el biológico Monjuvi en combinación con lenalidomida para adultos con linfoma difuso de células B grandes, recurrente o refractario. Esta marca de la alemana MorphoSys es la primera terapia de segunda línea en ser aprobada para dicha enfermedad. Su comercialización en los Estados Unidos estará a cargo de la firma europea en conjunto con la norteamericana Incyte. Ver Press Release.
Además, la agencia le otorgó la venia a la primera alternativa inyectable para la celulitis moderada a severa en mujeres adultas. Se trata del biológico Qwo que lleva el sello de la irlandesa Endo International y que se suministra vía subcutánea de forma no invasiva directamente en los glúteos.Ver artículo.
Otra novedad avalada fue Xywav de la irlandesa Jazz Pharmaceuticals. La misma se constituyó como el primer medicamento en ser autorizado por el organismo para la cataplexia y la somnolencia diurna excesiva. El producto, cuyo lanzamiento está proyectado para finales de 2020, apunta a personas a partir de los siete años, que tienen narcolepsia. Ver Press Release.
A su vez, la británica AstraZeneca obtuvo la aprobación para su Breztri Aerosphere, para adultos con EPOC. Consiste en una terapia de combinación triple basada en budesonide, glicopirrolato, y formoterol fumarate, la que fuera desarrollada por Pearl Therapeutics, una firma que AZ adquirió en el 2013. Ver artículo.
También recibió el OK Byfavo, un inyectable a base de remimazolam de la biofarmacéutica británica Acacia Pharma. Está indicado para la inducción y el mantenimiento de la sedación en procedimientos médicos invasivos que duran menos de 30 minutos, como la colonoscopia y la broncoscopia. Ver artículo.
Por último, la FDA le levantó el pulgar a Xeglyze, una loción tópica para la pediculosis de la india Dr. Reddy’s Laboratories. Es un tratamiento de un solo uso que elimina los piojos y los huevos que depositan. En 2015, la multi había comprado sus derechos a la australiana Hatchtech en los mercados de Norteamérica, India, Rusia, Australia, Nueva Zelanda y Venezuela. Ver aprobación.