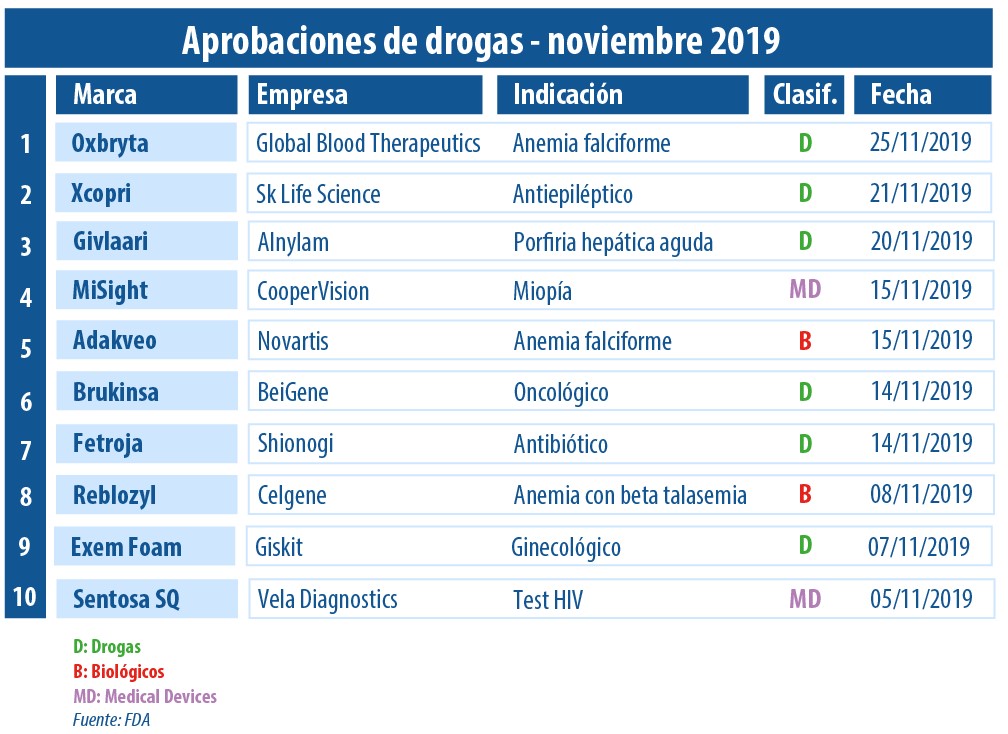
En noviembre, la FDA estuvo más que activa en materia de aprobaciones. Entre los diez avales más relevantes que otorgó, se destacan dos para biológicos. Fueron Adakveo de la suiza Novartis; y Reblozyl de la norteamericana BMS.
El mes de noviembre llegó a su fin y el equipo periodístico de Pharmabiz llevó a cabo un relevamiento de las principales moléculas y dispositivos médicos aprobados por la FDA.
A lo largo de este período los biológicos estuvieron presentes en la agenda del organismo regulatorio. Por caso, fue autorizado Adakveo de la suiza Novartis, para reducir la frecuencia de las crisis vasooclusivas en personas con enfermedad de células falciformes. Ver artículo.
Para la misma condición, también obtuvo el visto bueno Oxbryta de la norteamericana Global Blood Therapeutics. Dicha novedad a base de voxelotor se suma a un segmento en el que también compite Endari, la primera molécula disruptiva para esta indicación de Emmaus Medical, respaldada en julio de 2017. Ver artículo.
Además durante este período, fueron respaldados dos productos para la enfermedad de células falciformes. Uno de ellos fue Adakveo, y el otro fue Oxbryta de la norteamericana Global Blood Therapeutics.
Asimismo, la agencia le otorgó la venia a Reblozyl, desarrollado por las norteamericanas Acceleron y Celgene, que está siendo adquirida a nivel global por su par BMS. Este biológico fue avalado para la anemia con beta talasemia en adultos. Ver artículo.
Por otro lado, Brukinsa de la china BeiGene recibió luz verde por parte de la FDA. Se trata de un nuevo oncológico para linfoma de células del manto. El producto aprobado como tratamiento de segunda línea se constituyó en el primer aval que obtuvo la compañía. Ver artículo.
En materia de medical devices, el organismo le dio el OK a una dupla de dispositivos. Por un lado le levantó el pulgar a las lentes de contacto MiSight de la norteamericana CooperVision; y por el otro, al test Sentosa SQ de la norteamericana Vela Diagnostics.
A su vez, el antibiótico Fetroja de la japonesa Shionogi fue aprobado para infecciones complicadas del tracto urinario en personas adultas con opciones de terapia limitadas o nulas. El medicamento a base de cefiderocol estará disponible en el mercado a principios de 2020. Ver press release.
La FDA también le levantó el pulgar a Xcopri, un antiepiléptico con el sello de la norteamericana SK Life Science, brazo de la surcoreana SK Biopharmaceuticals. El producto a base de cenobamato trata las convulsiones de inicio parcial en adultos. Ver artículo.
En la categoría de medical devices, recibieron el sí las lentes de contacto MiSight de la norteamericana CooperVision. Las mismas apuntan a retrasar la progresión de la miopía en niños de entre 8 y 12 años. Otro dispositivo que logró el visto bueno fue Sentosa SQ de la norteamericana Vela Diagnostics. El mismo consiste en una prueba para detectar mutaciones de resistencia a los tratamientos de tipo 1 del virus del HIV. Ver press release. Ver press release.
Además, en noviembre la FDA le concedió la venia a Exem Foam de la holadensa Giskit. Se trata de una espuma que se utiliza para la detección de la permeabilidad de las trompas de Falopio en mujeres con infertilidad conocida o sospechada. Ver aprobación.